
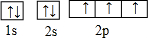
 ,O2-的结构示意图为
,O2-的结构示意图为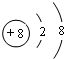 .H、O可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,该化合物为H2O2,该化合物的结构式H-O-O-H,分子中氧原子与氢原子之间为极性键、氧原子之间为非极性键,为展开书页型结构,是极性分子,
.H、O可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,该化合物为H2O2,该化合物的结构式H-O-O-H,分子中氧原子与氢原子之间为极性键、氧原子之间为非极性键,为展开书页型结构,是极性分子, ;
;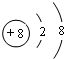 ;H-O-O-H;极性、非极性;极性;
;H-O-O-H;极性、非极性;极性;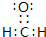 ,根据价层电子对互斥(VSEPR)理论,该分子中心原子C原子价层电子对水为3,不含孤电子对,故C原子的杂化方式为sp2杂化,空间构型为平面三角形,
,根据价层电子对互斥(VSEPR)理论,该分子中心原子C原子价层电子对水为3,不含孤电子对,故C原子的杂化方式为sp2杂化,空间构型为平面三角形,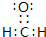 ;sp2;平面三角形;
;sp2;平面三角形;

 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源:四川省成都市六校协作体2011-2012学年高二上学期期中考试化学试题 题型:022
短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数.D和E可以形成原子个数比为1∶1和1∶2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是________(填元素符号或化学式,下同);第一电离能从大到小的顺序是________
(2)C原子的电子排布图________,D2-的结构示意图________.A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________,分子中含有________键(填“极性”或“非极性”,下同)是________分子.
(3)A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式________,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为________杂化,空间构型为________.
(4)C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质.则Y的化学式为________,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为![]() ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是 (填元素符号或化学式,下同);第一电离能从大到小的顺序是
(2)C原子的电子排布图_____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
(3) A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式_ _,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为 杂化,空间构型为__ 。
(4) C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为 ,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷 题型:填空题
(13分)短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是 (填元素符号或化 学式,下同);第一电离能从大到小的顺序是
学式,下同);第一电离能从大到小的顺序是
(2)C原子的电子排布图 _____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
_____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
(3) A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式_ _,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为 杂化,空间构型为__ 。
(4) C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为 ,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷 题型:填空题
(13分)短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为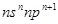 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是 (填元素符号或化学式,下同);第一电离能从大到小的顺序是
(2)C原子的电子排布图_____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
(3) A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式_ _,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为 杂化,空间构型为__ 。
(4) C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为 ,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com