
 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:分析 (1)①2CO(g)+O2(g═2CO2(g)△H1=akJ.mol-1 (i),N2(G)+O2(G)═2NO(g)△H2=bkJ.mol-1 (ii),(i)-(ii)得出目标方程式;
②根据氧化还原反应中氧化剂和还原剂的特点结合常见的氧化剂和还原剂来回答;
③石膏中含有元素Ca,结合反应原理判断固体物质即可;
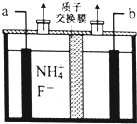
(2)由图可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,据此解答即可;
(3)依据常见金属保护方法回答即可.
解答 解:(1)①2CO(g)+O2(g═2CO2(g)△H1=akJ.mol-1 (i),N2(G)+O2(G)═2NO(g)△H2=bkJ.mol-1 (ii),(i)-(ii)得出目标方程式为:2NO(g)+2CO(g)?N2(g)+2CO2(g),故△H=(a-b)kJ.mol-1,故答案为:a-b;
②将NO2变成无害的N2中,氮元素的化合价降低了,二氧化氮做氧化剂,需要加入还原剂,X必须为无污染的物质,在下列四种物质:a.NH3 b.CO2 c.SO2 d.CH3CH2OH中,能被二氧化氮氧化具有还原性的物质有乙醇和NH3,NO2由+4价降低为0价,降低4价,即转移4mol电子,当反应中转移1.2mol电子时,消耗NO2 为0.3mol,体积为6.72L,故答案为:还原剂;ad;6.72;
③二氧化硫为酸性气体,除利用氢氧化钠浓溶液吸收外,还可以利用CaO或氢氧化钙吸收制取石膏,故还需要的固体物质是CaO或Ca(OH)2,故答案为:CaO或Ca(OH)2;(2)由图可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,阳极上铵根失去电子生成NF3,电极反应方程式为:NH4++3F--6e-=NF3+4H+,
故答案为:阳;NH4++3F--6e-=NF3+4H+;
(3)用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于覆盖保护层法,故答案为:覆盖并保护层.
点评 本题主要考查的是盖斯定律的应用、氧化还原反应方程式书写、电解池反应原理等,综合性较强,难度较大,注意整理归纳.


科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠(固体) | B. | 水 | C. | 硫酸钾溶液 | D. | 浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
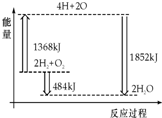
| A. | H2(g)和O2(g)反应生成H2O(g ),这是吸热反应 | |
| B. | 2 mol H2和1 mol O2转化为4 mol H、2 mol O原子的过程中放出热量 | |
| C. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O( g),共放出484 kJ能量 | |
| D. | 4 mol H、2 mol O生成2 mol H2O(g),共放出484 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L 1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在反应中,每生成3mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 3-甲基-1-丁烯.
3-甲基-1-丁烯.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸溶液中存在乙酸分子,能证明乙酸是一种弱酸 | |
| B. | 丙醛和乙醛都有醛基,都能和银氨溶液、新制氢氧化铜反应 | |
| C. | 除去工业乙醇中少量水常加入生石灰,并蒸馏 | |
| D. | 油脂、淀粉、蛋白质、纤维素属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃钢 | B. | 陶瓷 | C. | 二氧化硅 | D. | 聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com