
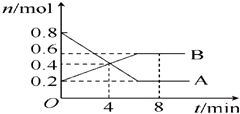
| △c |
| △t |
| n(转化量) |
| n(起始量) |
| ||
| t |
| ||
| 4min |
| n(转化量) |
| n(起始量) |
| 0.4mol |
| 0.8mol |


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、该碳氮化合物呈片层状结构 |
| B、该碳氮化合物呈立体网状结构 |
| C、该碳氮化合物中C-N键键长大于金刚石中C-C键键长 |
| D、相邻主族非金属元素形成的化合物的硬度比单质小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
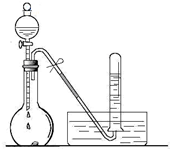 某校化学实验小组同学进行有关NO2气体的系列实验.
某校化学实验小组同学进行有关NO2气体的系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
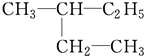 和
和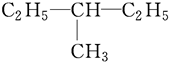
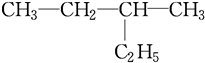 和
和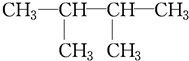
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com