
【题目】在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,质量分数为w,其中含有NH![]() 的物质的量是b mol,下列叙述正确的是( )
的物质的量是b mol,下列叙述正确的是( )
A. 溶质的质量分数w=![]() ×100%
×100%
B. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C. 溶液中c(OH-)=![]() mol·L-1+c(H+)
mol·L-1+c(H+)
D. 向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w
【答案】C
【解析】A项,氨水溶液溶质为氨气,该溶液的密度为ρgcm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,溶质的质量分数为![]() ×100%,故A错误;B项,a g NH3的物质的量为:
×100%,故A错误;B项,a g NH3的物质的量为: ![]() =
=![]() mol,溶液体积为VmL,所以溶液的物质的量浓度为:
mol,溶液体积为VmL,所以溶液的物质的量浓度为: ![]() mol÷(V×10-3 L)=
mol÷(V×10-3 L)=![]() mol·L-1,故B错误;C项,NH4+的浓度为:b mol÷(V×10-3 L)=
mol·L-1,故B错误;C项,NH4+的浓度为:b mol÷(V×10-3 L)=![]() mol·L-1,根据电荷守恒得,c(OH-)=c(NH4+)+c(H+)=
mol·L-1,根据电荷守恒得,c(OH-)=c(NH4+)+c(H+)=![]() mol·L-1+ c(H+),故C正确;D项,水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5w,故D错误。
mol·L-1+ c(H+),故C正确;D项,水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5w,故D错误。


科目:高中化学 来源: 题型:
【题目】植物油厂想要提取大豆中丰富的油脂,下列方案设计合理的是( )
A.将大豆用水浸泡,使其中的油脂溶于水,然后再分馏
B.先将大豆压成颗粒状,再用无毒的有机溶剂浸泡,然后对浸出液进行蒸馏分离
C.将大豆用碱溶液处理,使其中的油脂溶解,然后再蒸发出来
D.将大豆粉碎,然后隔绝空气加热,使其中的油脂挥发出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量金属钠投入到氯化铁溶液中,产物是
A. Fe(OH)3、NaCl,H2
B. Fe,NaCl
C. NaOH、H2
D. H2、NaCl、NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需要0.1 mol·L1CuSO4溶液240 mL,实验室提供以下试剂用于溶液的配制:蒸馏水、胆矾晶体(CuSO4·5H2O)、4 mol·L1CuSO4溶液
(1)无论采用何种试剂进行配制,除烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是_________,在使用该仪器前必须进行的操作是___________。
(2)若用胆矾晶体进行配制,需用托盘天平称取CuSO4·5H2O的质量为_______ g;如果用 4 mol/L的CuSO4溶液稀释配制,需用量筒量取________mL 4 mol/LCuSO4溶液。
(3)用4 mol/L的硫酸铜溶液稀释配制溶液所需的实验步骤有:
a.用量筒量取一定体积4 mol/L的硫酸铜溶液于一烧杯中
b.洗涤烧杯和玻璃棒2~3次并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
c.计算所需4 mol/L硫酸铜溶液的体积
d.盖好瓶塞,反复上下颠倒摇匀后,将溶液转存于试剂瓶中
e.加水至液面离容量瓶刻度线1~2 cm处改用胶头滴管进行定容
f.往烧杯中加入约100 mL水进行初步稀释,冷却至室温
g.将溶液转移入容量瓶
其中正确的操作顺序为______________________。
(4)下列操作对所配制溶液浓度的影响(填“偏高”“偏低”或“无影响”)。
①称取的胆矾晶体失去了部分结晶水___________。
②定容时,仰视刻度线:___________。
③容量瓶未干燥,有少量蒸馏水:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于有胆矾晶体存在的饱和硫酸铜溶液,下列措施不能破坏原溶液溶解平衡的是( )
A. 升高温度 B. 温度不变,蒸发部分水
C. 加入少量硫酸铜晶体 D. 加入少量无水硫酸铜粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
Ⅰ. CO还原法
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应_______(填“放出”或“吸收”)的热量为_________。

(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
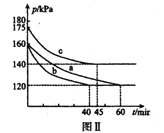
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g)![]() S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
Ⅱ.Na2SO3溶液吸收法
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。
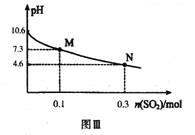
(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是____
A. NH3·H2O B. Na2S C. Na2CO3 D. FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A. 实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K= 1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度。则下列说法正确的是( )
A. 物质的量:甲>乙 B. 气体体积:甲>乙
C. 气体摩尔体积:甲>乙 D. 相对分子质量:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子在指定的分散系中能大量共存的一组是( )
A.空气:HCl、CO2、SO2、NO
B.烧碱溶液:K+、HCO![]() 、NO
、NO![]() 、NH3·H2O
、NH3·H2O
C.高锰酸钾溶液:H+、Na+、SO![]() 、CH3COOH
、CH3COOH
D.氢氧化铁胶体:H+、K+、S2-、Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com