
| A. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液的pH=7 | |
| B. | 把镁粉加入FeCl3饱和溶液中,有气体和红褐色沉淀生成 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液蒸干的方法 | |
| D. | 盐类水解反应的逆反应是酸碱中和反应,但酸碱中和反应不一定是可逆反应. |
分析 A.25℃时,等体积等浓度的硝酸与氨水混合后,生成硝酸铵,水解显酸性;
B.FeCl3饱和溶液水解显酸性,Mg与氢离子反应促进铁离子水解;
C.水解生成的盐酸挥发;
D.有弱酸或弱碱离子的盐可水解,强酸与强碱的中和反应不可逆.
解答 解:A.25℃时,等体积等浓度的硝酸与氨水混合后,生成硝酸铵,水解显酸性,则溶液pH<7,故A错误;
B.FeCl3饱和溶液水解显酸性,Mg与氢离子反应促进铁离子水解,则有气体(氢气)和红褐色沉淀(氢氧化铁)生成,故B正确;
C.水解生成的盐酸挥发,则制备AlCl3、FeCl3、CuCl2均不能采用将溶液蒸干的方法,应在HCl气流中蒸发,故C正确;
D.有弱酸或弱碱离子的盐可水解,强酸与强碱的中和反应不可逆,则盐类水解反应的逆反应是酸碱中和反应,但酸碱中和反应不-定是可逆反应,故D正确;
故选A.
点评 本题考查pH的计算及盐类水解应用,为高频考点,把握水解规律及酸碱混合反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.37 | B. | 0.24 | C. | 0.16 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
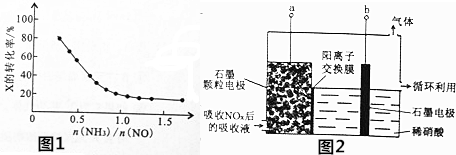
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
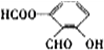 、
、 、
、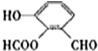 ..
..查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:填空题
CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量____________(填“>”“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①能表示该反应过程中能量变化的是____________(填字母)。
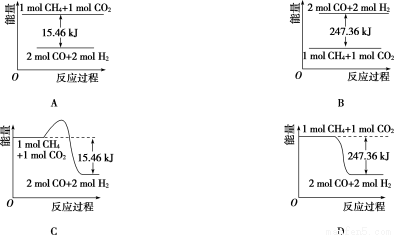
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为____________。
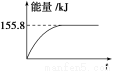
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=____________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_______________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(C O、H2)
O、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
在C(s)+CO2(g)==2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强 ②增加碳的量 ③通入CO2④恒容下充入N2 ⑤恒压下充入N2能够使反应速率增大的措施是( )
A.①④ B.②③⑤ C.①③ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com