
 请按要求回答下列有关氮的化合物参与相关反应的问题:
请按要求回答下列有关氮的化合物参与相关反应的问题:| n(NO)/mol | n(CO)/mol | n(N2)/mol | n(CO2)/mol | |
| 起始 | 1.2 | 1.0 | 0 | 0 |
| 2min末 | 0.4 | |||
| 4min末 | 0.8 |
分析 Ⅰ.NH4Cl和NaNO2反应生成N2,NaCl和H2O,并据强酸,强碱,大多数盐拆,书写离子方程式;
Ⅱ.(1)据△G=△H-T△S,进行判断,若△G<0,反应能自发进行,据此进行分析;
(2)①据v=$\frac{△c}{△t}$进行计算;
②据K=$\frac{C({N}_{2}){C}^{2}(C{O}_{2})}{{C}^{2}(NO){C}^{2}(CO)}$进行计算;据方程式前面的系数,4minCO20.8mol,故CO的变化量为0.8mol,据v(CO)=$\frac{n变}{n原}×100%$,进行分析;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)①据影响平衡移动的因素分析;
②据温度升高反应向吸热方向进行作图;
解答 解:Ⅰ.NH4Cl+NaNO2=N2+NaCl+2H2O,并据强酸,强碱,大多数盐拆,故离子方程式为NH4++NO2-=N2↑+2H2O,
故答案为:NH4++NO2-=N2↑+2H2O;
Ⅱ.(1)据△G=△H-T△S,若△G<0,反应能自发进行,此反应△S<0,△H<0,故只有低温时才能确保△G<0,
故答案为:低温;
(2)①2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0
开始(c) 0.6 0.5 0 0
变化 0.4 0.4 0.2 0.4
2min 0.2 0.1 0.2 0.4
v(NO)=$\frac{0.4mol/L}{2min}$=0.2mol/(L.min),
故答案为:0.2mol/(L.min);
②K=$\frac{C({N}_{2}){C}^{2}(C{O}_{2})}{{C}^{2}(NO){C}^{2}(CO)}$=$\frac{0.2×0.{4}^{2}}{0.{2}^{2}×0.{1}^{2}}$=80;
据方程式前面的系数,4minCO20.8mol,故CO的变化量为0.8mol,据v(CO)=$\frac{0.8mol}{1.0mol}×100%$=80%,
故答案为:80;80%;
(3)A.消耗CO和消耗NO都指的是正反应,故不能说明反应达到平衡,故A错误;
B.N2与CO2的物质的量之比为1:1时,不能说明体系浓度不变,故不能说明反应达到平衡,故B错误;
C.这是一个气体体积变化的反应,混合气体的密度保持不变,即浓度不变,故能说明反应达到平衡,故C正确;
D..这是一个气体体积变化的反应,气体平均相对分子质量保持不变,即气体总物质的量不变,体积是定值,由c=$\frac{n}{V}$,即浓度不变,故能说明反应达到平衡,故D正确;
故答案为:CD;
(4)①t2min时氮气的浓度瞬间从3mol/L变化到4.5mol/L,故t2min时改变的条件是快速将容器的体积由3L压到2L,
故答案为:快速将容器的体积由3L压到2L;
②由于温度升高反应向吸热方向进行,故t2~t4内c(N2)的变化曲线为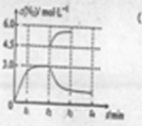 ;
;
答:t2~t4内c(N2)的变化曲线为 .
.
点评 本题考查化学反应速率计算、化学平衡计算、化学平衡状态判断,难度不大,侧重对基础知识的巩固,注意判断化学平衡状态的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.


科目:高中化学 来源: 题型:选择题
| A. | 从溶解的整个过程来看,既包含着物理变化,又包含着化学变化 | |
| B. | 氯化钠溶于水达到饱和后,溶解过程并没有停止 | |
| C. | 氯化钠溶于水中,无论是否形成饱和溶液,都存在溶解与结晶的过程 | |
| D. | 将K37Cl投入到K35Cl的饱和溶液中,溶液中溶质的质量会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3+OH- | |
| D. | 向KAl(SO4)2溶液中加过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
| 420℃ | 0.9961 | 0.9972 | 0.9984 |
| 520℃ | 0.9675 | 0.9767 | 0.9852 |
| 620℃ | 0.8520 | 0.8897 | 0.9276 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=b时,发生的离子总反应为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当3a≤2b时发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=b时,发生的离子总反应为:Ba2++3OH-+2CO2═BaCO3↓+H2O+HCO3- | |
| D. | 2a<b<3a时,溶液中n(HCO3-)=(2b-3a)mol |
查看答案和解析>>
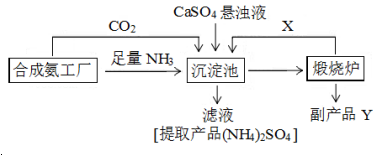
科目:高中化学 来源: 题型:实验题
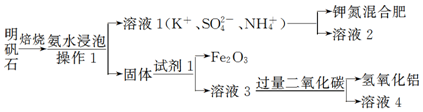
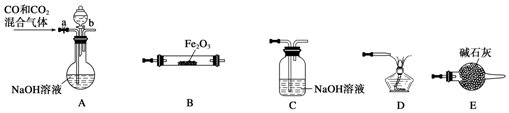
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 增大压强 | 正、逆反应速率都增大量 | Z的浓度减小 |
| B | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
| C | 充入少量Z | v(逆)>v(正) | Z的浓度减小 |
| D | 升高温度 | 逆反应速率增大量大于 正反应速率增大量 | Z的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com