
 O2(g)
O2(g)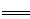 FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1  CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1 Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
 2Fe2+ + Cu2+ (2分)
2Fe2+ + Cu2+ (2分) CO2+H2O(2分)
CO2+H2O(2分) 2Fe2+ + Cu2+ ;
2Fe2+ + Cu2+ ; O2(g)═FeO(s)△H=-272 kJ·mol-1
O2(g)═FeO(s)△H=-272 kJ·mol-1 Fe(s)+CO2(g)△H=-1lkJ·mol-1;
Fe(s)+CO2(g)△H=-1lkJ·mol-1; =0.1mol,
=0.1mol, ×(0.16L×5mol·L-1-0.2mol)=0.2mol,
×(0.16L×5mol·L-1-0.2mol)=0.2mol, CO2+H2O;
CO2+H2O;

 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
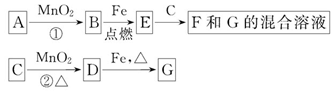
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe2+具有还原性 | 取少量0.1 mol·L-1 FeCl2溶液,加入足量__________后,再往溶液中加入少量__________ | 溶液变成血红色 |
| 探究Fe2+具有氧化性 | 取少量0.1 mol·L-1 FeCl2溶 液,加入_________充分 反应 | 溶液由浅绿色变无色 所发生反应离子方程式为________________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡。 | 若溶液颜色明显改变, 且有红色固体生成。 | 有Fe存在。 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水将固体洗涤至洗涤液呈无色。 | | |
| 步骤3:取步骤2得到的少量固体于试管中,滴加过量盐酸,静置后取上层清液, 。 | 。 | 有FeO存在。 |
查看答案和解析>>
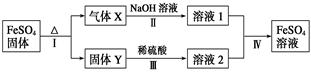
科目:高中化学 来源:不详 题型:计算题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
查看答案和解析>>
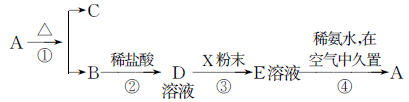
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定条件下,铁粉可与水蒸气反应 | B.不锈钢是铁合金,只含金属元素 |
| C.铁与盐酸反应,铁合金不与盐酸反应 | D.在空气中,铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com