

| A.镁作Y电极 |
| B.电池工作时,Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
| D.X电极上发生的反应为ClO-+2H2O-4e-===ClO3-+4H+ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题

A.若X为NaCI,K与M相连时,石墨电极反应为 |
| B.若X为硫酸,K与M相连时,Fe作负极受到保护 |
| C.若X为硫酸,K与N相连时,溶液中H+向Fe电极移动 |
| D.若X为NaCI,K与N相连时,溶液中加入少量K3[Fe(CN)6],有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

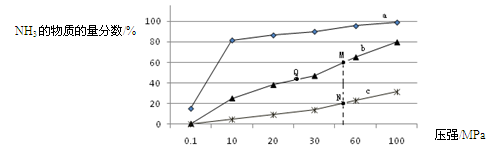

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。
2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。| A.NiO(OH) | B.Ni(OH)2 |
| C.H2 | D.H2和NiO(OH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
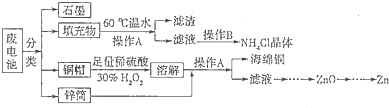

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.氢氧燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
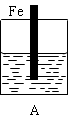
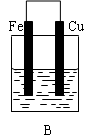
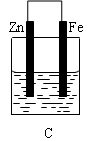
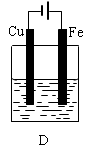
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com