
(14分)钛酸锶是电子工业的重要原料,与BaTO3相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具有优良稳定性。因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。制备高纯、超细、均匀SrTiO3的方法研究日益受到重视。我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均22nm。已知SrTiO3立方晶胞参数a=390.5pm。
1.写出水热法合成纳米钛酸锶的反应方程式;
2.SrTiO3晶体的结构可看作由Sr2+和O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由O2-构成,另一种由Sr2+和O2-一起构成,Ti4+只填充在O2-构成的八面体空隙中。
(1)画出该SrTiO3的一个晶胞(Ti4+用小![]() 球,O2-用大○球,Sr2+用大
球,O2-用大○球,Sr2+用大![]() 球)
球)
(2)容纳Ti4+的空隙占据所有八面体空隙的几分之几?
(3)解释为什么Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙?
(4)通过计算说明和O2-进行立方密堆积的是Sr2+而不是Ti4+的理由(已知O2-半径为140pm)
3.计算22nm(直径)粒子的质量,并估算组成原子个数。
1.H2TiO3+SrCl2+2KOH=SrTiO3+2H2O+2KCl(2分)
2.(1)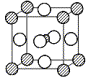 (2分)
(2分)
(2)1/4(1分)
(3)容纳Ti4+的八面体空隙处于晶胞的中心,是由6个最邻近的O2-氧负离子所构成。其他的八面体中心均位于晶胞边棱的中心,虽然最邻近的微粒数也是6,但其中只有4个是O2-,另外两个是Sr2+。两个正离子Sr2+和Ti4+彼此靠近,从静电学角度分析是不利的。(2分)
(4)Sr2+半径为(390.5×![]() -140×2)/2=136pm;
-140×2)/2=136pm;
Ti4+半径为(390.5-140×2)/2=55pm(各1分)
Sr2+半径与O2-半径相近,而Ti4+半径小得多,适合填充在八面体空隙中(1.5分)
4.ρ=M/NAa3=5.12g/cm3(1分) V=πd3/6=5.57×10-18cm3(0.5分)
m=ρV=2.85×10-17g(1分) N=5×V/a3=4.68×105个(1分)


科目:高中化学 来源: 题型:
| O | 2- 4 |
| O | 2- 7 |
| O | 2- 7 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三百校大联考一模考试化学试卷 题型:实验题
(15分)氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1
KC1O3↓+NaC1制取。
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。

(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e—
C12↑阴极:2H2O+2e—
H2↑+2OH—
液相反应:C12+H2O HC1O+H++C1—
HC1O
HC1O+H++C1—
HC1O H++C1O—
H++C1O—
2HC1O+CO— C1O3—+2C1—+2H+
①
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂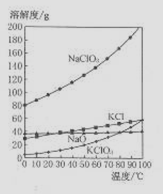
② 是 、 、 ;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O2,其目的是防止 (填离子符号)电解过程中在阴极上放电。
(4)若NaC1O2与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为 (填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O2标准溶液滴定至终点。
步骤4: 。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是 。
②步骤3中K2Cr2O2标准溶液应盛放在 中(填仪器名称)。
③为了确定样品中C1O2—的质量分数,步骤4的操作内容是 。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2012届江苏省高三百校大联考一模考试化学试卷 题型:实验题
(15分)氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1 KC1O3↓+NaC1制取。
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH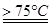 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。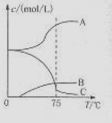
(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e— C12↑阴极:2H2O+2e— H2↑+2OH—
液相反应:C12+H2O HC1O+H++C1— HC1O
HC1O+H++C1— HC1O H++C1O—
H++C1O—
2HC1O+CO— C1O3—+2C1—+2H+
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂
是 、 、 ;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O7,其目的是防止 (填离子符号)电解过程中在阴极上放电。
(4)若NaC1O3与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为 (填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O7标准溶液滴定至终点。
步骤4: 。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是 。
②步骤3中K2Cr2O2标准溶液应盛放在 中(填仪器名称)。
③为了确定样品中C1O3—的质量分数,步骤4的操作内容是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com