
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g) CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
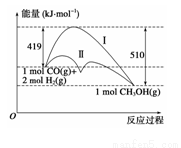
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量小于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH减小
科目:高中化学 来源:2015-2016学年青海西宁第四高级中学高二下期末化学卷(解析版) 题型:选择题
www..com下列物质与水混合后静置,不出现分层的是( )
A. 三氯甲烷 B. 乙醇 C. 苯 D. 四氯化碳
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一下学期期末考试化学卷(解析版) 题型:填空题
(17分)A、B、D、E、F为短周期元素,非金属元素A 最外层电子数与其周期数相同,B 的最外层电子数是其所在周期数的2 倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A 在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F 的离子方程式_______。
(2)B、D、E组成的一种盐中,E 的质量分数为43%,其俗名为_____,其水溶液与F单质反应的化学方程式:_______。在产物中加入少量KI,反应后加入CCl4并振荡,有机层显___色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;c的电子式为 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,这种新能源物质在海底和冰川储童丰富,是巨大的潜在能源。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一下学期期末考试化学卷(解析版) 题型:选择题
用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为 x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为( )
A. 量筒 B. 容量瓶 C. 滴定管 D. 以上均不对
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳市高一下期末考试化学卷(解析版) 题型:填空题
甲醇是一种重要的化工原料和新型燃料。
(1)工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH=-90.8 kJ·mol-1。在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。下图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是________;该温度下上述反应的化学平衡常数为________;
CH3OH(g) ΔH=-90.8 kJ·mol-1。在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。下图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是________;该温度下上述反应的化学平衡常数为________;

(2)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

I.甲中负极的电极反应式为_________ _______
II.乙中反应的化学方程式为______ __ ________;A极析出的气体在标准状况下的体积为________________。
III.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如下图,则图中②线表示的是________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳市高一下期末考试化学卷(解析版) 题型:选择题
太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如图)。已知发出白光的LED是将GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。下列说法中不正确的是( )
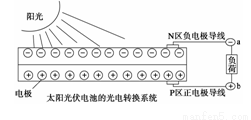
A.光伏发电是将太阳能转变为电能
B.Ga与N在元素周期表中不处于同一主族
C.YAG中钇显+3价
D.上图中N区半导体为负极,P区半导体为正极,电流从a流向b
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳市高一下期末考试化学卷(解析版) 题型:选择题
某二元酸(H2A)在水中的电离方程式为H2A===H++HA-,HA- H++A2-(25 ℃时Ka=1.0×10-2),下列有关说法中正确的是( )
H++A2-(25 ℃时Ka=1.0×10-2),下列有关说法中正确的是( )
A.H2A是弱酸
B.稀释0.1 mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大
C.在0.1 mol/L的H2A溶液中,c(H+)=0.12 mol/L
D.若0.1 mol/L NaHA溶液中c(H+)=0.02 mol/L,则0.1 mol/L的H2A中c(H+)<0.12 mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳市高二下期末考化学卷(解析版) 题型:选择题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是( )

A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南文昌中学高一下期末考试化学卷(文)(解析版) 题型:实验题
(15分)乙酸是食醋的主要成分,它具有以下化学性质:
(1)可使紫色石蕊试液变_____色,说明乙酸具有__________性。
(2)能发生酯化反应.实验室用下图所示装置制取乙酸乙酯,
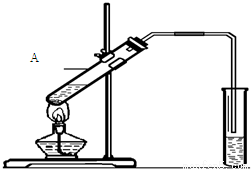
在试管A中加入的试剂有______(填写名称)、浓硫酸和冰醋酸,请写出该反应的化学方程式:______________________,浓硫酸在反应中起_________________(填一种即可)作用,生成的乙酸乙酯密度比水________(填“大”或“小”),并可以闻到有______________味。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com