
 ;
;
分析 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素,A、C的最外层电子数都是其电子层数的2倍,则A是C元素,C是S元素,透过蓝色钴玻璃观察E的焰色反应为紫色,E是K元素,D的原子序数介于S与K元素之间,故D为Cl元素,B的电负性大于C,且B的原子序数小于C,属于不同主族,所以B是N元素,F位于第四周期,基态原子中有4个未成对电子,外围电子排布为3d64s2,则F是Fe元素.
(1)Fe元素原子失去3个电子形成Fe3+,根据核外电子排布式规则书写;
(2)氨气分子与水分子之间存在氢键;
(3)化合物FD3则100℃左右时升华,熔沸点较低,属于分子晶体;化合物ECAB中的阴离子是SCN-,AC2是CS2,二者核外等电子体,根据二硫化碳的电子式写出硫氰根离子的电子式;
(4)氯化铁和硫氰化钾溶液混合生成络合物,其中配位数为5的配合物,即配离子为[Fe(SCN)5]2-,进而书写配合物化学式;
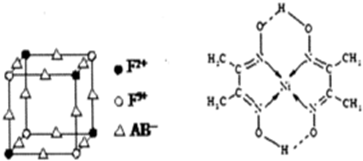
(5)化合物EF[F(AB)6]是KFe[Fe(CN)6],利用均摊法计算一个晶胞的$\frac{1}{8}$中含有的离子,结合化学式确定钾离子个数;
利用均摊法计算$\frac{1}{8}$晶胞质量,$\frac{1}{8}$晶胞体积为(p×10-10cm)3,晶胞密度ρ=$\frac{m}{V}$;
(6)B元素的具有18个电子的氢化物可用作火箭燃料,其原理是:B2O4(l)+2B2H4(l)=3B2(g)+4H2O(g),则B为N元素,其氢化物为N2H4,1molN2H4发生反应生成N2为1.5mol,氮气结构式为N≡N,分子中含有2个π键;
由图可知,C原子之间存在非极性键,C原子与N原子之间、C原子与H原子之间、C原子与O原子之间形成极性键,O原子与H原子之间存在极性键、氢键
解答 解:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素,A、C的最外层电子数都是其电子层数的2倍,则A是C元素,C是S元素,透过蓝色钴玻璃观察E的焰色反应为紫色,E是K元素,D的原子序数介于S与K元素之间,故D为Cl元素,B的电负性大于C,且B的原子序数小于C,属于不同主族,所以B是N元素,F位于第四周期,基态原子中有4个未成对电子,外围电子排布为3d64s2,则F是Fe元素.
(1)Fe元素原子失去3个电子形成Fe3+,Fe3+核外电子排布式为:1s22s22p63s23p63d5,则M层电子排布式是3s23p63d5,
故答案为:3s23p63d5;
(2)NH3与H2O分子间存在氢键,其它分子与H2O分子间不存在氢键,所以氨气的溶解性大;
故答案为:NH3与H2O分子间存在氢键,其他分子与H2O分子间不存在氢键;
(3)氯化铁的熔点较低,为分子晶体,把二硫化碳分子中的一个硫原子换成N原子,则硫氰根离子的电子式为 ,
,
故答案为:分子晶体; ;
;
(4)氯化铁和硫氰化钾溶液混合生成络合物,其中配位数为5的配合物,即配离子为[Fe(SCN)5]2-,该配合物化学式为K2Fe(SCN)5;
故答案为:K2Fe(SCN)5;
(5)晶胞的$\frac{1}{8}$(E+未画出)中,亚铁离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$,铁离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$,CN-离子个数=12×$\frac{1}{4}$=3,所以晶胞中亚铁离子个数是$\frac{1}{2}$×8=4,铁离子个数是$\frac{1}{2}$×8=4,CN-离子个数=3×8=24,化合物EF[F(AB)6]是KFe[Fe(CN)6],根据各离子的个数比知,晶胞中钾离子个数是4;
图中$\frac{1}{8}$晶胞质量为$\frac{M}{{N}_{A}}$×$\frac{1}{4}$g,$\frac{1}{8}$晶胞体积为(p×10-10cm)3,故晶胞密度为($\frac{M}{{N}_{A}}$×$\frac{1}{4}$g)÷(p×10-10cm)3,
=$\frac{4M}{{N}_{A}(a×1{0}^{-10})^{3}}$g/cm3,
故答案为:4;$\frac{4M}{{N}_{A}(a×1{0}^{-10})^{3}}$;
(6)B元素的具有18个电子的氢化物可用作火箭燃料,其原理是:B2O4(l)+2B2H4(l)=3B2(g)+4H2O(g),则B为N元素,其氢化物为N2H4,1molN2H4发生反应生成N2为1.5mol,氮气结构式为N≡N,故则形成的π键数目为1.5mol×2×NAmol-1=3NA;
C原子之间存在非极性键,C原子与N原子之间、C原子与H原子之间、C原子与O原子之间形成极性键,O原子与H原子之间存在极性键、氢键,故选:ABCD;
故答案为:3NA;ABCD.
点评 本题是对物质结构的考查,涉及核外电子的排布、氢键、等电子体、晶胞的计算、配合物等知识点,难度较大,(5)中晶胞计算为易错点、难点,注意利用均摊法进行晶胞计算,难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
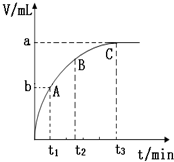 某同学在实验室进行实验研究化学反应速率的影响因素.
某同学在实验室进行实验研究化学反应速率的影响因素.浓 度 反应条件 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加 热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第9列元素中没有非金属元素 | |
| B. | 第17列为卤族元素 | |
| C. | 只有第2列元素原子的最外层有2个电子 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  称量NaOH固体 | B. |  配制一定物质的量浓度稀硫酸 | ||
| C. |  制取少量的Fe(OH)3胶体 | D. |  用H2SO4标准溶液滴定NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
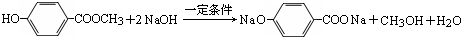 .
.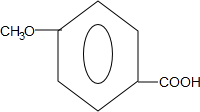 .
. 和ClCH2CH═CH2 合成丁香油酚的反应类型为取代反应.
和ClCH2CH═CH2 合成丁香油酚的反应类型为取代反应.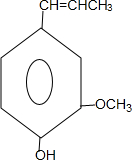 +CH3OCOCOCH3→
+CH3OCOCOCH3→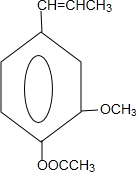 +CH3COOH.
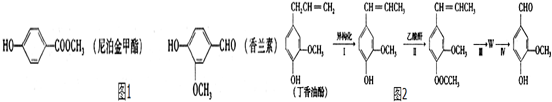
+CH3COOH.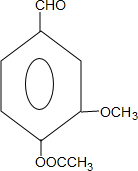 _.
_.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol由元素A、B组成的化合物一定含有18mole- | |
| B. | 化合物AE与DE3有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素D的最高价氧化物对应的水化物可以溶于过量的氨水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | M | |
| W |
| A. | 原子半径:W>Y>Z>M>X | |
| B. | 热稳定性:XM>X2Z,沸点:X2Z>YX3 | |
| C. | X、Y、Z三种元素形成的化合物中不可能含离子键 | |
| D. | ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com