
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用渗析法除去淀粉中混有的NaCl | |
| D. | 已知${I}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
分析 A.反应生成沉淀;
B.应先加KSCN排除铁离子的干扰;
C.淀粉的粒子较大,透不过半透膜,离子可以;
D.静置后CCl4层显紫色,溶解可碘单质.
解答 解:A.向饱和FeCl3溶液中滴加过量氨水得到的是Fe(OH)3沉淀,不是胶体,故A错误;
B.由于没有先加KSCN溶液而直接加了氯水,所以不能确定原溶液是有Fe2+还是Fe3+,故B错误;
C.根据淀粉的粒子较大,透不过半透膜,可用渗析的方法除去淀粉中混有的少量氯化钠杂质,故C正确;
D.使CCl4层显紫色的是I2,而不是I3-,所以说明I2在CCl4层中的溶解度大,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、物质的分离以及离子检验等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题

| A. | ①⑤ | B. | ②⑥ | C. | ①④ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾与水反应时增大水的用量 | |
| B. | 铝与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | 实验室制取二氧化碳时,将块状大理石改为粉状大理石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
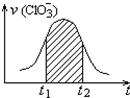 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )| A. | 反应开始时速率增大可能是c(H+)增大引起的 | |
| B. | 纵坐标为v(H+)的速率-时间曲线与图中曲线不能完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 图中阴影部分“面积”为t1至t2时间内的ClO3-的物质的量的减小值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
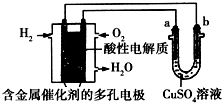
| A. | 此装置用于铁表面镀铜时,a为铁 | |
| B. | 此装置用于电镀铜时,硫酸铜溶液的浓度不变 | |
| C. | 燃料电池中正极反应为$\frac{1}{2}$O2+2e-+2H+═H2O | |
| D. | 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
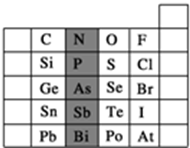 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
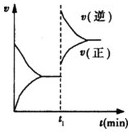
| A. | t1时,一定是缩小了容器的体积 | |
| B. | t1时,可能是向容器中通入了一定量的C气体 | |
| C. | t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 | |
| D. | t1时,可能是向容器中加入了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com