
【题目】某无色透明溶液,在强酸性环境下能大量共存的离子组是( )
A.Na+、SO42-、HCO3-、Cl-B.K+、Cl-、NO3-、Fe2+
C.Cu2+、Cl-、NH4+、SO42-D.Mg2+、Cl-、Na+、NO3-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】恒温时向2 L密闭容器中通入一定量的气体X和Y,发生反应:2X(g)+Y(g)![]() 3Z(g) ΔH<0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是
3Z(g) ΔH<0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是
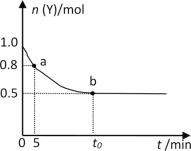
A. 该反应为吸热反应
B. 0~5min内,以X表示的化学反应速率是0.02 mol·L-1·min-1
C. b点时该反应达到了最大限度,反应停止
D. t0min时,c(Z)=0.75 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性:
(1)写出实验室制取W2反应的离子方程式:________________________。
(2)某小组设计如图所示的实验装置(图中夹持和加热装置略去),分别研究YX2、W2的性质。
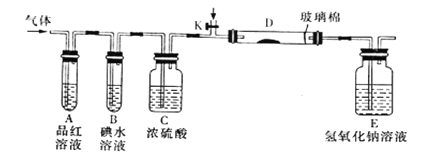
①分别通入YX2和W2,在装置A中观察到的现象是否相同_________________(填“相同”、“不相同”);若装置D中装的是铁粉,当通入W2时D中观察到的现象为__________;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学方程式为_______________________________________。
②若装置B中装入5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为__________________。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量_____(填字母)可以看到白色沉淀生成。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(4)如由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入足量氯化钡溶液,有白色沉淀产生,且两种沉淀物质量相等。写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的各步转化中,均可通过一步反应实现的是( )
A.Si→SiO2→H2SiO3→Na2SiO3B.Na→NaOH→Fe(OH)3→Fe2O3
C.Cu→CuO→Cu(OH)2→CuCl2D.NaOH→NaCl→Cl2→FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为几种短周期元素的性质,回答下列问题:
元素编号 | A | B | C | D | E | F | G | H |
原子半径/10-1nm | 0.74 | 1.54 | 1.30 | 1.18 | 1.11 | 1.06 | 0.99 | 0.75 |
最高或最低化合价 | -2 | +1 | +2 | +3 | +4,-4 | +5,-3 | +7,-1 | +5,-3 |
(1)E元素在元素周期表中的位置是_____;C元素与G元素形成化合物的电子式_____ 。
(2)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为_________。
(3)B2A2中含有的化学键为_______,该物质与水反应的化学反应方程式为________。
(4)下列说法不正确的是______(填序号)。
①H的气态氢化物水溶液能导电,说明H的气态氢化物为电解质
②最高价氧化物对应水化物的碱性:B>C>D
③D的最高价氧化物对应水化物可以溶于氨水
④元素气态氢化物的稳定性:F>A>G
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=13的NaOH溶液与pH=2的HCl溶液按1∶9的体积比混合,设混合溶液的总体积为二者相加,则所得混合液的pH值是
A. 11 B. 15 C. 12 D. 7.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R都是中学化学中常见物质,它们均含有同一种短周期元素,在一定条件下可发生如图所示的转化,其中X是单质,Y在常温下是气态氢化物,Z、W是氧化物R是W和水反应的产物。下列判断错误的是( )
![]()
A. X不可能是金属单质 B. Y生成Z属于置换反应
C. Z生成W发生了电子转移 D. Y和R可能会发生反应生成一种盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和铵盐用途广泛。
(1)工业合成氨的反应是 N2+3H2![]() 2NH3 。
2NH3 。
① 一定温度下,在某500mL的密闭容器中充入3mol H2 和 1 mol N2,3min后反应达平衡,H2的物质的量为0.75mol,求
a. H2的转化率,_________
b.平衡时NH3的体积分数______。(写出计算过程)
② 对上述反应,下列说法不正确的是____________
A.正反应方向和逆反应方向均能进行的化学反应统称为可逆反应
B.当可逆反应的正反应速率和逆反应速率相等时,该反应达到化学平衡状态
C.化学反应的限度决定了反应物在该条件下的最大转化率
D.改变可逆反应的反应条件可以在一定程度上改变其化学平衡状态
(2)已知日常所用的干电池中,其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作为电解质,电极反应可简化为2NH4+ + 2e-=2NH3+H2 (还加入填充物MnO2,用于吸收H2生成水,NH3与Zn2+结合为稳定物质)。根据以上信息,日常所用的干电池的正极是__________,负极是_______。工作时电子由_______极流向_______极,当生成25.5克NH3时,转移______mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com