
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
B. 某密闭容器盛0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
C. 1 mol Na与足量O2在一定条件下完全反应时转移电子数为NA
D. 1 mol·L-1Na2SO4溶液中,Na+和SO![]() 离子数的总和一定为3NA
离子数的总和一定为3NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸氢钠溶液与少量澄清石灰水反应:HC![]() +Ca2++OH-CaCO3↓+H2O
+Ca2++OH-CaCO3↓+H2O
B. 氯化铵与氢氧化钠两种溶液混合加热:N![]() +OH-
+OH-![]() H2O+NH3↑
H2O+NH3↑
C. 钠和冷水反应:Na+2H2ONa++2OH-+H2↑
D. 向氯化铝溶液中滴加过量氨水:Al3++3OH-Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是进行化学研究的重要手段之一。请回答下列问题:
(1)实验室需要450 mL 1 mol·L-1硫酸溶液。
①配制1 mol·L-1的硫酸时,下列仪器肯定不需要的是_________(填标号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有________________。
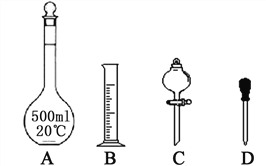
②在容量瓶的使用方法中,下列操作正确的是_______(填写序号)。
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制硫酸溶液时,用量筒量取浓硫酸后用玻璃棒引流注入容量瓶中,然后加水。
(2)如图装置中,若A中盛有品红溶液,B中盛有氢氧化钠溶液。
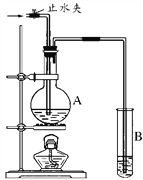
①向A中通入足量的SO2气体,然后加热,A中的现象_____________。
②向A中通入足量的Cl2气体,然后加热,A中的现象是_____________。
③若将SO2和Cl2按1:1体积比(同温同压)同时通入A中,则溶液不褪色。原因是SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是______________________。
(3)若(2)中的A中盛的是浓硫酸,加入足量的锌后,关闭止水夹并加热,进入B溶液的气体的化学式为____________;B中发生反应的离子方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成导电高分子材料PPV 的反应: ![]()
下列说法正确的是( )
A.合成PPV 的反应为加聚反应
B.PPV 与聚苯乙烯具有相同的重复结构单元
C.![]() 和苯乙烯互为同系物
和苯乙烯互为同系物
D.通过质谱法测定PPV 的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝与NO3-在酸性或碱性条件下均可反应,回答下列问题:
(1)为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,完善并配平该反应:__Al +___NO3- + ___OH- = ____________+ ____N2↑ + ____H2O。每消耗1mol NO3-,转移的电子数目为_____。
(2)某同学取一定质量的铁铝合金与100mLxmol/L稀硝酸充分反应,反应过程中没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。

①写出EF段发生反应的离子方程式_________________________________________。
② C点对应的溶液中含有的阳离子除Na+外,还含有___________________________。
③ x=_________。
④铁铝合金中铝的物质的量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磁性流体材料广泛应用于减震、医疗器械、声音调节等高科技领域。下图是制备纳米Fe3O4磁流体的两种流程:

(1)分析流程图中的两种流程,其中______(填“流程1”、“流程2”)所有反应不涉及氧化还原反应。步骤①反应的离子方程式为____________。
(2)步骤②保持50℃ 的方法是_____________。
(3)步骤③中加入的H2O2电子式是_______,步骤③制备Fe3O4磁流体的化学方程式为_______。
(4)流程2中FeCl3和FeCl2制备Fe3O4磁流体,理论上FeCl3和FeCl2物质的量之比为_____。己知沉淀B为四氧化三铁.步骤⑤中操作a具体的步骤是____________。
(5)利用K2Cr2O7可测定Fe3O4磁流体中的Fe2+含量。若Fe3O4磁流体与K2Cr2O7充分反应消耗了0.01mol·L -1的K2Cr2O7标准溶液100mL,则磁流体中含有Fe2+的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com