
【题目】已知下列元素的原子半径:
元素 | N | S | O | Si |
原子半径/1010 m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷元素的原子半径可能是
A. 0.80×1010 m B. 1.10×1010 m
C. 1.20×1010 m D. 0.70×1010 m
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列实验设计或操作能达到实验目的是
A. 除去乙烷中的乙烯气体:加入氢气在催化剂的作用下发生加成反应
B. 检验溴乙烷消去产物:反应装置经水浴加热后,将生成物直接通入酸性高锰酸钾溶液中
C. 检验柠檬醛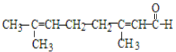 中含有碳碳双键:先加入银氨溶液充分反应后,再加入酸性高锰酸钾溶液检验
中含有碳碳双键:先加入银氨溶液充分反应后,再加入酸性高锰酸钾溶液检验
D. 除去甲苯中的少量苯酚:加入浓溴水,振荡、静置、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是

A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是( )
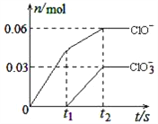
A. 苛性钾溶液中KOH的物质的量是0.09mol
B. ClO3-的生成是由于氯气的量的多少引起的
C. 在酸性条件下ClO-和ClO3-可生成Cl2
D. 反应中转移电子的物质的量是0.21mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 澄清石灰水中通入过量二氧化碳:OH-+CO2=HCO3-
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. 漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClO- = SO42-+Cl-+2H+
D. 下图所示装置中反应:Zn+Cu2+= Cu + Zn2+
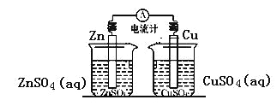
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Li、Al、Si构成的某三元化合物固态晶胞结构如图所示,下列说法不正确的是
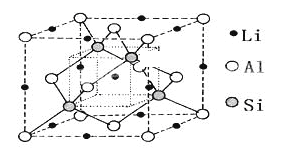
A. 晶体中Al和Si构成金刚石型骨架 B. 该化合物化学式可表示为LiAlSi
C. 晶体中与每个Al距离最近的Li为6个 D. 晶体中Al和Li构成CsCl型骨架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___________,已知:K(300 ℃)>K(350 ℃),该反应的逆反应是_______反应(填“放热”或“吸热”)。
(2)图中表示NO2的变化的曲线是____________,用O2的浓度变化表示从0~2 s内该反应的平均速率v=_____________。
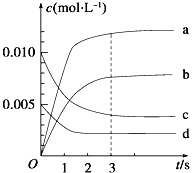
(3)能说明该反应已经达到平衡状态的是________。
a v(NO2)=2v(O2) b 容器内压强保持不变
c v逆(NO)=2v正(O2) d 容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a 及时分离出NO2气体 b 适当升高温度
c 选择高效的催化剂 d 增大O2的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3
B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布图为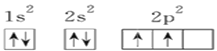
D. Z元素具有两性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com