
下列离子方程式正确的是
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO +2OH-===CaCO3↓+CO
+2OH-===CaCO3↓+CO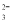 +2H2O
+2H2O
C.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO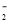 +4NH
+4NH +2H2O
+2H2O
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。Fe(CO)x常温下呈液态,熔点为 -20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含ρ、NA的计算式表示)

(3)原子序数小于36的X、Y、Z、M、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,M基态原子中s电子数等于p电子数。W的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为 ,空间构型 。
②基态W原子的核外电子排布式 。
③Y、Z、M三种元素的第一电离能由大到小的顺序为 (用元素符号表示)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
④元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
⑤YM、ZM混合气体污染的处理方法之一是将其在催化剂作用下转化为Z的单质。
已知::①YM(g)+ 1/2M2(g)=YM2(g) △H=-283.0kJ·mol-1
②Z2(g)+ M2(g)=2ZM(g) △H=+180.5kJ·mol-1
则上述反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
已知氧化性:Cl2> Fe3+ >I2。向FeI2溶液中加入一定量的氯水,有关离子方程式错误的是
A.2 I-+ Cl2 →I2 + 2Cl-
B.2Fe2+ + 2I-+ 2Cl2 → 2Fe3+ + I2 + 4Cl-
C.2Fe2+ + 4I-+ 3Cl2 → 2Fe3+ + 2I2 + 6Cl-
D.2Fe2+ + 6I-+ 4Cl2 → 2Fe3+ + 3I2 + 8Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
(9分) 向浓度相等、体积均为50 mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100 mL。
(1)在KOH溶液中通入一定量的SO2气体后,溶液中溶质的组成可能是:
① ;② ;
③ ;④ 。
(2)在稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生SO2的体积(标准状况)与所加盐酸的体积关系如下图所示。

①A曲线表明,原溶液通入SO2气体后,所得溶质与盐酸反应产生SO2的最大体积是____mL(标准状况)。
②B曲线表明,原溶液通入SO2气体后,所得溶液中溶质的化学式为_________________。
③原KOH溶液的物质的量浓度为________ ____。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下表中叙述Ⅰ和叙述Ⅱ均正确并且互为因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | NH4Cl是强酸弱碱盐 | 将NH4Cl溶液蒸干可制备NH4Cl固体 |
B | Fe3+有强氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | SO2有还原性 | 用SO2可使溴水褪色 |
D | Cl2有漂白性 | 用Cl2可与石灰乳反应制备含氯消毒剂 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
对下列化学用语的理解正确的是
A.原子结构示意图 :可以表示12C,也可以表示14C
:可以表示12C,也可以表示14C
B.比例模型 :可以表示二氧化碳分子,也可以表示水分子
:可以表示二氧化碳分子,也可以表示水分子
C.电子式: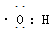 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
D.分子式C2H4O2:可以表示乙酸,也可以表示乙二醇
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2===NO3-+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应:2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应:2MnO4-+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO42-+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三1月练习理综化学试卷(解析版) 题型:填空题
某些有机化合物之间具有如下转化关系:

其中A是一种五元环状化合物,其分子中只有一种化学环境的氢原子;F核磁共振氢谱显示有三种化学环境的氢原子,且峰面积之比为2:2:3。
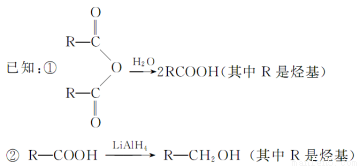
(1)G是合成顺丁橡胶的主要原料,G的名称是 。B中含氧官能团的名称是
(2)A的结构简式是
(3)⑥的化学方程式是
(4)E在一定条件下能够发生缩聚反应,其中主链上含“—CH2—”的高聚物的结构简式是 。有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有 种。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:填空题
(16分)实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
(1)已知:① 2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
③ CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0= kJ·mol-1
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
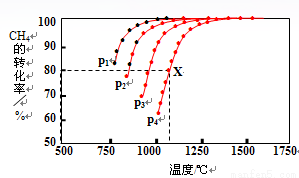
据图可知,p1、p2、 p3、p4由大到小的顺序 。
(3)CO和H2还可以通过反应C(s)+H2O(g) CO(g)+H2 (g) 制取。
CO(g)+H2 (g) 制取。
① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是
A.体系压强不再变化 B.CO与H2的物质的量之比为1:1
C.混合气体的密度保持不变 D.每消耗1mol H2O(g)的同时生成1mol H2
② 恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),反应的平衡常数K= 。
若此时增大压强,平衡将向 (填“正”、“逆”)反应方向移动,t1min时达到新的平衡。
③ 请画出增大压强后10min~t1min时容器中H2物质的量n随时间变化的曲线图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com