
| A. | t℃时,HA的Ka=10-2b/1000a/MV | |
| B. | 物质的量浓度:c(HA)=1000a/MV mol•L-1 | |
| C. | t℃时,HA的溶解度:S=100a/ρV g | |
| D. | HA的质量分数:ω(HA)=(a/ρV)×100% |
分析 A.根据溶液的pH=b计算出该溶液中氢离子浓度,由于水电离的氢离子浓度较小,则c(H+)≈c(A-);根据$\frac{\frac{m}{M}}{V}$计算出HA的浓度,然后结合电离平衡常数的表达式计算;
B.根据c=$\frac{n}{V}$计算出物质的量浓度c(HA);
C.根据饱和溶液中溶解度S=$\frac{{m}_{溶质}}{{m}_{溶剂}}$×100g进行计算t℃时HA的溶解度;
D.根据溶质的质量分数w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算出HA的质量分数w(HA).
解答 解:A.溶液的pH=b,则该溶液中氢离子浓度为10-bmol/L,由于水电离的氢离子浓度较小,则c(H+)≈c(A-)=10-bmol/L;ag HA的物质的量为:$\frac{ag}{Mg/mol}$=$\frac{a}{M}$mol,则物质的量浓度c(HA)=$\frac{\frac{a}{M}mol}{V×1{0}^{-3}L}$=$\frac{1000a}{MV}$mol/L,HA的电离程度较小,则溶液中c(HA)≈$\frac{1000a}{MV}$mol/L所以HA的电离平衡常数为:$\frac{1{0}^{-b}×1{0}^{-b}}{\frac{1000a}{MV}}$=$\frac{1{0}^{-2b}}{\frac{1000a}{MV}}$,故A正确;
B.ag HA的物质的量为:$\frac{ag}{Mg/mol}$=$\frac{a}{M}$mol,则物质的量浓度c(HA)=$\frac{\frac{a}{M}mol}{V×1{0}^{-3}L}$=$\frac{1000a}{MV}$mol/L,故B正确;
C.溶液的质量为:m=VmL×ρg•cm-3=ρVg,t℃时HA的溶解度S=$\frac{{m}_{溶质}}{{m}_{溶剂}}$×100g=$\frac{ag}{ρVg-ag}×100g$=$\frac{100a}{ρV-a}$,故C错误;
D.该溶液的质量为m=VmL×ρg•cm-3=ρVg,HA的质量分数w(HA)=$\frac{ag}{ρVg}$×100%=$\frac{a}{ρV}$×100%,故D正确;
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,注意熟练掌握物质的量与物质的量浓度、摩尔质量之间的关系,明确电离平衡常数、溶质质量分数的计算方法,试题培养了学生的化学计算能力.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体NaHSO4,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)减小 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
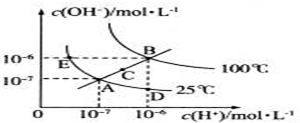
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸、食盐水 | B. | 氨水、碘酒 | C. | 石灰水、硝酸 | D. | 稀硫酸、食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ•mol1) | 414.4 | 615.3 | 347.4 | 435.3 |
| A. | +125.6 kJ•molˉ1 | B. | -125.6 kJ•molˉ1 | C. | +46.1 kJ•molˉ1 | D. | -46.1 kJ•molˉ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物,分散在空气中不可能形成胶体 | |
| B. | 生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品 | |
| C. | 食品添加剂对人体均有益,可随意使用 | |
| D. | 洪涝、地震灾区灾后可用石灰消毒,是利用石灰可使蛋白质变性的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
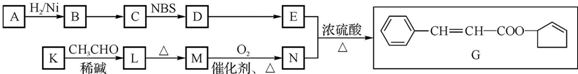
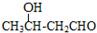
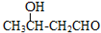 $\stackrel{△}{→}$CH3CH=CHCHO+H2O
$\stackrel{△}{→}$CH3CH=CHCHO+H2O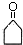 .
. .
.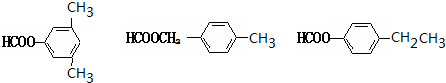 (其中两种).
(其中两种).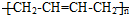 ).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{氢氧化钠醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$
).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{氢氧化钠醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$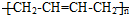 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
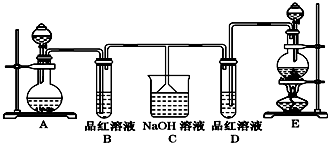
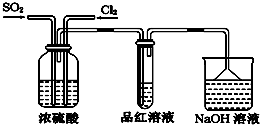
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是把物质的质量和微观粒子数联系起来的一个基本物理量 | |
| B. | 1摩尔H2SO4的质量为98g/mol | |
| C. | 国际上规定,0.012 kg 碳原子所含有的碳原子数目为 1 mol | |
| D. | 1摩尔氢气分子可以表示为1mol H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com