
| A. | 在NaHS溶液中滴入少量CuCl2溶液,产生黑色沉淀,HS-水解程度增大 | |
| B. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| C. | 0.1 mol•L-1 Na2SO3溶液加入少量NaOH固体,c(SO32-)与c(Na+)均增大 | |
| D. | 常温下pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) |
分析 A、NaHS溶液中滴入少量CuCl2溶液,HS-电离出的S2-与Cu2+结合生成CuS沉淀;
B、pH=2的盐酸溶液中c(H+)=0.01mol/L,pH=12的NaOH溶液中c(OH-)>0.01mol/L,二者等体积混合,NaOH有剩余;
C、加入少量NaOH固体,平衡:SO32-+H2O?HSO3-+OH-向逆反应方向移动,据此回答;
D、根据溶液中电荷守恒结合离子浓度之间的关系来回答.
解答 解:A、在NaHS溶液中,滴入少量CuCl2溶液,HS-电离出的S2-与Cu2+结合生成CuS沉淀,HS-电离程度增大,pH减小,故A错误;
B、pH=2的盐酸溶液中c(H+)=0.01mol/L,pH=12的NaOH溶液中c(OH-)>0.01mol/L,二者等体积混合,NaOH有剩余,则混合溶液呈碱性,故B错误;
C、加入少量NaOH固体,平衡:SO32-+H2O?HSO3-+OH-向逆反应方向移动,所以c(SO32-)与c(Na+)均增大,故C正确;
D、常温下pH=7的NaHSO3与Na2SO3混合溶液中:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),pH=7,此时:c(H+)=c(OH-),所以c(Na+)=c(HSO3-)+2c(SO32-),故D错误.
故选C.
点评 本题考查了盐类水解、盐的水解平衡移动原理以及溶液中的离子之间的守恒关系知识,注意知识的迁移应用是关键,难度不大.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
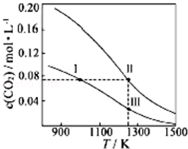
| A. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| B. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| C. | 体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
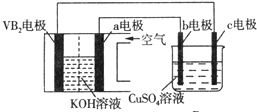
| A. | 电解过程中,c电极表面先有红色物质析出,后有气泡产生 | |
| B. | 外电路中电子由c电极流向VB2电极 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
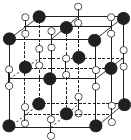 I.氮族元素和卤族元素都能形成许多种物质.
I.氮族元素和卤族元素都能形成许多种物质.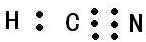 ;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).| F | Cl | Br | I | |
| 第一电力能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO32-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| C. | 醋酸钠溶液和盐酸混合:CH3COONa+H+═CH3COOH+Na+ | |
| D. | 铁跟氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 液态氯化氢不导电,说明它是共价化合物 | |
| B. | 若电解质溶液中分子和离子同时存在,电离方程中只能采用“?”表示 | |
| C. | 相同条件下,强电解质溶液的导电性一定比弱电解质溶液强 | |
| D. | 物质导电的本质是存在自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 乙烷(乙烯) | 溴水 | 分液 |
| B | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| C | 乙醇(少量水) | CaO | 蒸馏 |
| D | 乙醇(苯酚) | 适量的溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com