
����Ŀ����Ԫ����һ���ж��ֻ��ϼ۵ķǽ���Ԫ�ء�
��1�������ĵ���56 g����ַ�Ӧ��ת�Ƶĵ�����Ϊ NA����ӦKIO4+8HI![]() 4I2+KI+4H2O���������뻹ԭ�������ʵ���֮��Ϊ ��
4I2+KI+4H2O���������뻹ԭ�������ʵ���֮��Ϊ ��
��2����һ֧�Թ��а�ij˳��������м�������(һ������ֻ��һ��)��
A��KI��Һ B��������Һ C��NaOH��ҺD��ϡH2SO4 E��H2O2��Һ
������Һ��ɫ�����±仯������ɫ�����ػ�ɫ������ɫ������ɫ������ɫ�������ҩƷ��˳����(д���) ����������Ӧ�Ļ�ѧ����ʽΪ ��
��3����ҵ���ƵõĴֵ���ͨ����±�ػ�����ICl��IBr������ʱICl��IBr������I2һ���������ڴֵ��м�������ѡ���е�һ�����ʺ��ٽ����������Ƶþ��⣬Ӧ����������� ��
a.KBr b.KCl c.KI d.Zn
��4����һ�ֵ����������Գ�Ϊ����⣬���е�Ԫ�س�+3��+5���ּ�̬�������ֻ�����Ļ�ѧʽ�� ��
��5��ҽҩ��ҵ����Ҫԭ�ϸߵ����ƿɲ��������������Ʊ�������������ͼ��
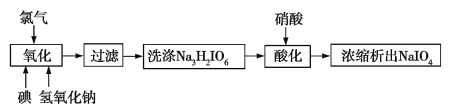
д�����������з�����Ӧ�����ӷ���ʽ�� ��
���𰸡���1��2 1��7
��2��A��E(��E��A)��B��C��D I2+2NaOH![]() NaI+NaIO+H2O
NaI+NaIO+H2O
��3��c
��4��I4O9[��I(IO3)3]
��5��I2+6Na++20OH+7Cl2![]() 2Na3H2IO6��+14Cl+8H2O
2Na3H2IO6��+14Cl+8H2O
��������������Ҫ����⼰�仯��������ʣ����ڿ��鿼���Ի�ѧ֪ʶ������������ ��1������ⷴӦʱֻ����FeI2������������ԭ��Ӧ���ɡ�ֻ��£�����桱��ԭ��֪HI���������ã�����ԭ�����ᡣ
��2��KIΪ��ɫ��Һ(A)������H2O2��Һ(E)��Ӧ���ɵ⣬��Ϊ�ػ�ɫ��Ȼ��ӵ��۱���ɫ(B)���ټ�NaOH��Һ(C)��Ӧ����NaI��NaIO����Һ�ֱ�Ϊ��ɫ������ϡ����(D)������������ԭ��Ӧ���ɵ��ʵ⣬��Һ�л��е��ۣ��ֱ��������Լ���ҩƷ��˳����A��E(��E��A)��B��C��D����������Ӧ�Ļ�ѧ����ʽΪI2+2NaOH![]() NaI+NaIO+H2O��
NaI+NaIO+H2O��
��3�����õ����������Ծ��Ƶ⣬��ʹICl��IBr�е�Cl��BrԪ�ر�Ϊ�ѻӷ��Ե����ʣ�ͬʱʹ����+1�۵ĵⱻ��ԭΪ���ʵ⣬�Ҽ�������ʺ͵ⲻ��Ӧ��ֻ��KI���ϣ���ѧ����ʽΪICl+KI![]() I2+KCl��IBr+KI
I2+KCl��IBr+KI![]() I2+KBr��
I2+KBr��
��4�������ΪIm(IO3)n�����е����Ϊ1���ҵ������IΪ+5�ۣ���ǰ���IΪ+3�ۣ����Ի�ѧʽΪI(IO3)3����I4O9��
��5����������֪����Ӧ����Cl2��NaOH��I2���������г���Na3H2IO6���������������ԭ��Ӧ����֪��Ӧ�õ�NaCl������ԭ���غ�֪����H2O���ɡ�
����ע���Ե⼰�仯����Ϊ���忼�����ʵ����ʡ�������ԭ��Ӧ���ɡ���ѧ����ʽ�����ӷ���ʽ����д��֪ʶ��ǿ��Ԫ�ػ�����֪ʶ�����龳�µ�Ӧ�ã��������ۺ����ڽ������ĸ߿�������ռ�ı���һֱ�ϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2016�Ϻ�]NaCN����ĵ�Ʒ�ˮ��������������������
��1��NaCN��NaClO��Ӧ������NaOCN��NaCl
��2��NaOCN��NaClO��Ӧ������Na2CO3��CO2��NaCl��N2
��֪HCN��Ki=6.3��1010���о綾��HCN��HOCN��NԪ�صĻ��ϼ���ͬ��
���������գ�
��1����һ������ʱ����Һ��pHӦ����Ϊ____________________��ѡ����ԡ��������ԡ������ԡ�����ԭ����______________________________��
��2��д���ڶ�������ʱ������Ӧ�����ӷ���ʽ��_______________________________________
��3������100 m3��NaCN 10.3 mg/L�ķ�ˮ��ʵ��������NaClO___________g��ʵ������ӦΪ����ֵ��4��������ʹNaCN��������0.5 mg/L���ﵽ�ŷű�����
��4��(CN)2��Cl2�Ļ�ѧ�������ơ�(CN)2��NaOH��Һ��Ӧ����_________��__________��H2O��
��5��������Ӧ�漰����Ԫ���У���ԭ�Ӻ������������ߵĵ����Dz���___________��H��C��N��O��Na��ԭ�Ӱ뾶��С�����˳��Ϊ_______��
��6��HCN��ֱ���ͷ��ӣ�HCN��___________���ӣ�ѡ����ԡ������Ǽ��ԡ�����HClO�ĵ���ʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���й�����,ȡ��������Һ20mL������ˮϡ����500mL�������м���m gþǡ����ȫ��Ӧ��
����
����ʽ �� HCl
��Է���������36.5
�ܶȣ�1.2g/cm3
HCl������������36.5��
��1��д��þ�����ᷴӦ�Ļ�ѧ����ʽ _____________________
��2����ϡ�ͺ���������ʵ���Ũ��_______________
��3����m��ֵ________________
��4����Ӧ�����ɵ�H2���Ժͱ�״����_______������O2ǡ����ȫ��Ӧ��
��5����Ӧ����Һ�����ʵ����ʵ���Ũ��Ϊ____________mol��L-1�����跴Ӧ������仯���Ժ��Բ��ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A����ӦN2 (g) +3H2 (g) ![]() 2NH3 (g)����H < 0����S >0
2NH3 (g)����H < 0����S >0
B�����¸����ܵ��õ�������п����Լ����ܵ��ĸ�ʴ
C�������£�Ksp[Mg(OH)2]=5.6��10-12��pH=10�ĺ�Mg2+��Һ�У�c(Mg2+ )��5.6��10-4 mol��L-1
D�����³�ѹ�£�п��ϡH2SO4��Ӧ����11.2 L H2����Ӧ��ת�Ƶĵ�����Ϊ6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� Cl2 ͨ�� NaBr �� NaI �Ļ��Һ�У�����Ӧ��ֺ����õ���Һ�������ɣ������գ���� ���Ĺ�����ȴ���������������ù����������ͨ�� Cl2 �������ϵ��ͼ��ʾ����ԭ���Һ�� NaI ���� �ʵ���Ϊ�� ��

A. 0.5 mol B. 0.4 mol C. 0.3 mol D. 0.25 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����c��CH3COOH��+c��CH3COO-��=0.1molL-1��һ����ᡢ�����ƻ����Һ����Һ��c��CH3COOH����c��CH3COO-����pH�Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ��������ȷ���ǣ�������

A. pH=5.5����Һ�У�c��CH3COOH����c��CH3COO-����c��H+����c��OH-��
B. ���¶��´���ĵ���ƽ�ⳣ��Ϊ10-4.75
C. pH=3.5����Һ�У�c��Na+��+c��H+��+c��OH-��+c��CH3COOH��=0.1molL-1
D. ��W������ʾ����Һ�м���������0.05molL��1NaOH��Һ��c��H+��=c��CH3COOH��+c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˵���� 1~18 ������Ԫ�� W��X��Y��Z��ԭ���������α�С��ԭ�Ӻ�����Ӳ���֮���� 8��W ����������ɫ���塢������ǿ���ڿ�����ȼ�շ�����ɫ�Ļ��棻X Ԫ��ԭ���������Ӳ��ϵĵ����� �� Y �� Z ��Ԫ��ԭ��������ϵĵ��������ܺͣ�Y Ԫ��ԭ�ӵ�������Ӳ��ϵĵ����������ĵ��Ӳ��� �� 2 ����X �� Z �����γ� XZ3 �Ļ������ش�
��1��X Ԫ�ص�ԭ�ӽṹʾ��ͼ��________________��Y Ԫ�ص�������________________��Z ���� ���ӵĵ���ʽ��________________��
��2���ֱ�д�� X��Y ����ۺ�����Ļ�ѧʽ________________��________________��
��3��W �� X ���γɻ����������ˮ���ҷ�Ӧ���� XZ3���������Ļ�ѧ����ʽΪ��________________���û������� W ���ӵĵ���ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ҹ������ƾõ���ʷ������������ϲ����������˳ƺȲ�Ϊ������������Ҷ�к��зḻ�Ŀ�����(C8H10N4O2����Է�������Ϊ194)�����˷�����������ƣ�͡����һ���躬��0.194 g���������������ʵ���Ϊ(����)
A. 4.00��10��3mol B. 3.00��10��3mol
C. 2.00��10��3mol D. 1.00��10��3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��֪A��B��C��D��E��F����Ԫ�����ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵�������ε�����B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ������������Ϊ������������3����E��Dλ��ͬһ���塣A��B��D����Ԫ����ɵ�һ�ֻ�����X����װ�����г����е�һ���к����塣��A��C��D��E��F����Ԫ�ذ���ԭ�Ӹ�����Ϊ14��4��5��1��1�γɵĻ�����YΪ����ɫ���塣
�ش��������⣺
(1) ��̬Eԭ�ӵļ۵����Ų�ͼΪ_____________________��
(2) �γɻ�����Y������Ԫ���е�һ������������__________���縺��������________(��Ԫ�ط���)��
(3) ������X����ԭ�ӵ��ӻ���ʽΪ________��X�����е����ּ��ǵĴ�С��ϵ��_________________(�á�XYZ��ʾ��X��Y��Z����Ԫ�ط���)��
(4) C2D���ӵ�����ṹΪ________________��A�ֱ���B��C�γɵļ������ۡ��е��ɸߵ���˳��Ϊ________(�û�ѧʽ��ʾ)����˵��ԭ��_________________��
(5) ����Y�д��ڵĻ�ѧ��������_____________________��������ţ�
A�����Ӽ� ��B���Ǽ��Թ��ۼ� C����λ����D����� E���Ҽ� ��F��������
(6) ��ͼ��D��F����Ԫ���γɵĻ�����ľ����ṹʾ��ͼ��F����λ����_______________����֪���������������Dԭ�Ӽ����Ϊa nm������٤��������NA��ʾ����þ�����ܶ�Ϊ__________g/cm3(�ú�a��NA�ı���ʽ��ʾ)��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com