
科目:高中化学 来源: 题型:
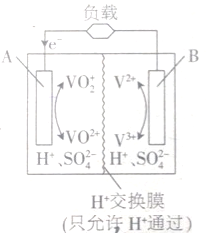 (1)B电极为电池的
(1)B电极为电池的查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3与BaCl2溶液作用,有白色沉淀生成,加硝酸后沉淀不消失 |
| B、将SO2气体通入Ba(OH)2溶液中有白色沉淀生成 |
| C、将SO2气体通入BaCl2溶液中有白色沉淀生成 |
| D、将SO2气体通入硝酸酸化的BaCl2溶液中有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2通入CaCl2溶液中 |
| B、NO2通入FeSO4溶液中 |
| C、NH3通入AlCl3溶液中 |
| D、SO2通入已酸化的Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸、甲苯、硝基苯 |
| B、苯、苯酚水溶液、酒精水溶液 |
| C、乙醛、乙酸乙酯、溴苯 |
| D、淀粉粉末、蔗糖粉末、石蕊粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取 5.2mL 盐酸 |
| B、用100mL量筒量取 5.2mL 盐酸 |
| C、用托盘天平称取25.02g NaCl |
| D、用100 mL 容量瓶配制 50 mL 0.1 mol/L 的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、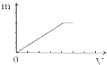 |
B、 |
C、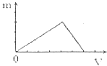 |
D、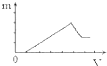 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中一定有K+、Br-、CO32-、AlO2- |
| B、溶液中一定没有Mg2+、Cu2+、Cl-、NH4+ |
| C、不能确定溶液中是否有H+、K+、SO42-,Cl- |
| D、溶液中一定有NH4+、Mg2+、Br-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下NH3?H2O分子可能存在于pH=6的酸性溶液中 |
| B、在0.1mol?L-1氢氧化钠中加入适量的蒸馏水,溶液的c(H+)增大 |
| C、由水电离出的c(H+)=1×10-12mol?L-1的溶液中,AlO2-不可能大量存在 |
| D、在c(H+)=c(OH-)的溶液中,CO32-不可能大量存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com