
| A. | 两溶液中水电离出的c(H+)=1×10-3mol/L | |
| B. | 加水稀释100倍后两溶液pH比较,硫酸的大 | |
| C. | 醋醋中c(CH3COO-)与硫酸中的c(SO42-)相同 | |
| D. | 两溶液中分别加入足量锌片放出H2体积硫酸多 |
分析 A.水溶液中存在离子积常数,计算水电离出的氢氧根离子浓度即可;
B.醋酸存在电离平衡,稀释促进电离;
C.依据溶液中氢离子浓度计算比较;
D.醋酸浓度大于硫酸,存在电离平衡.
解答 解:A.pH=3的醋酸和pH=3的硫酸两种溶液中,存在离子积常数,[H+]酸•[OH-]水=10-14,所以两溶液中水电离出的c(H+)均为1×10-11mol•L-l,故A错误;
B.加水稀释100倍后两溶液的pH不相同,醋酸存在电离平衡,稀释pH增大程度小,而硫酸pH增大多,即硫酸的pH大,故B正确;
C.pH=3的醋酸和pH=3的硫酸两种溶液中氢离子浓度相同,为0.001mmol/L,c(CH3COO-)=0.001mol/L;c(SO2-4)=0.0005mol/L,故C错误;
D.pH=3的醋酸和pH=3的硫酸两种溶液中氢离子浓度相同,醋酸浓度大于硫酸,分别加入足量锌片,等体积时,醋酸放出H2氢气多,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡应用、水的离子积的应用、溶液稀释pH判断,解决本题的关键是理解弱电解质电离平衡的存在,侧重于考查学生的分析能力,题目难度不大.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.30 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应,水是氧化剂 | |
| B. | 少量钠可以保存在煤油中 | |
| C. | 钠与硫酸铜溶液反应,既有沉淀产生,又有气体生成 | |
| D. | 23g钠在空气中充分燃烧生成Na2O2时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的CHCl3所含的分子数为0.5NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| D. | 现有乙烯、丙烯的混合气体共28g,其中碳原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LH2O含有的分子数目为0.1NA | |
| B. | 1mol/LCu(NO3)2溶液中NO3-的数目为2NA | |
| C. | 2.4gMg转变成Mg2+失电子的数目为0.2NA | |
| D. | 6.2gNa2O所含Na+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O+互为同分异构体 | |
| B. | H2O+有较强的氧化性 | |
| C. | 水分子形成的“网”是一种新化合物 | |
| D. | H2O(s)→H2O(l)→H2O(g)的变化过程中会破坏H-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 氧化物 | 含氧酸 | 碱 | 盐 | |
| A | 空气 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
| B | 冰水混合物 | Na2O | NaHSO4 | NaOH | NaCl |
| C | 水煤气 | CuO | HCl | NH3.H2O | CaF2 |
| D | 盐酸 | Na2O2 | HNO3 | Ca(OH)2 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
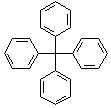 甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )| A. | 分子式为C25H20 | |
| B. | 所有碳原子可能在同一平面上 | |
| C. | 该化合物分子一定处于同一平面的原子至少有12个 | |
| D. | 分子中可能处于同一平面的原子最多有23个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com