
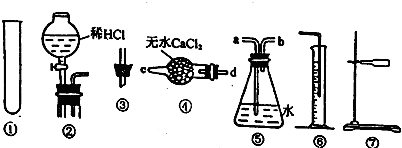
| ||
| aL |
| 22.4L/mol |
| a |
| 11.2 |
| a |
| 22.4 |
| b |
| 22.4 |
| b-a |
| 22.4 |
| b-a |
| 22.4 |
| 106(b-a) |
| 22.4 |
| a |
| 11.2 |
| 84a |
| 11.2 |
| ||||
|
| 106(b-a) |
| 106b+62a |
| 106(b-a) |
| 106b+62a |


科目:高中化学 来源: 题型:
| A、CaCO3与盐酸反应制CO2:CaCO3+2H+→Ca2++H2O+CO2↑ | ||
B、实验与浓硫酸反应制HCl:H2SO4(浓)+Cl-
| ||
C、电解熔融的氯化钠:2Cl-+2H2O
| ||
| D、Ba(OH)2与小苏打恰好完全反应:Ba2++HCO3-→BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
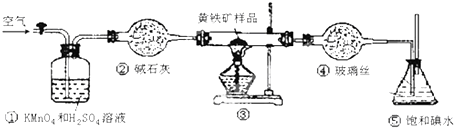
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前对碱式滴定管仰视读数,滴定后又俯视 |
| B、滴定前锥形瓶内含有少量水 |
| C、滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失 |
| D、碱式滴定管用蒸馏水洗净后,直接装入已知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
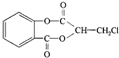 )在一定条件下可以发生如图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如图所示的转化(其他产物和水已略去).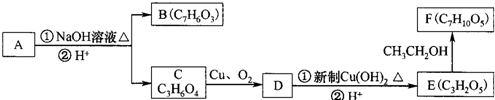
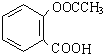 (即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有
(即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有 )经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
)经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH | 浓H2SO4 |
| 170℃ |
| H2 |
| 催化剂/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验步骤 | 实验现象 |
| ① | 取样,将其置于大试管中,加入一定量水,静置片刻 | 上层有黄色固体漂浮,中层为无色液体,下层有较多白色固体 |
| ② | 取少量中层液体滴加无色酚酞试液 | 无色酚酞试液变红 |
| ③ | 另取少量中层液体进行焰色反应 | 火焰呈现砖红色 |
| ④ | 取少量黄色固体灼烧 | 燃烧,放热,产生淡蓝色火焰,有刺激性气味 |
| ⑤ | 向下层白色固体中滴加足量稀盐酸 | 固体完全溶解,但仅产生少量气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
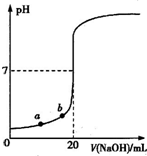
| A、水电离出的氢离子浓度:a>b |
| B、盐酸的物质的量浓度为0.0100mol?L-1 |
| C、指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D、当滴加NaOH溶液10.00mL时,该混合液的pH=1+lg3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com