
分析 由不同非金属元素形成的化学键为极性键;由同种非金属元素形成的化学键为非极性键;只含非极性键的分子为非极性分子;若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子;极性分子中正负电荷的中心不重合,具有一定的极性,以此来解答.
解答 解:HF中含有极性键,正负电荷的中心不重合,属于极性分子,分子极性最大;
H2O中含有极性键,空间结构为折线型,属于极性分子;
NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子;
CH4中含有极性键,空间结构为正四面体,正负电荷的中心重合,属于非极性分子;
N2中只含非极性键,属于非极性分子;
CO2含有极性键,空间结构为直线型,属于非极性分子;
HI中含有极性键,正负电荷的中心不重合,属于极性分子;
(1)以非极性键结合的非极性分子是N2;故答案为:N2;
(2)以极性键相结合,具有正四面体结构的非极性分子是CH4;故答案为:CH4;
(3)以极性键相结合,具有三角锥型结构的极性分子是NH3;故答案为:NH3;
(4)以极性键相结合,具有折线型结构的极性分子是H2O;故答案为:H2O;
(5)以极性键相结合,而且分子极性最大的是HF;故答案为:HF;
(6)元素的非金属性越强,其氢化物越稳定,几种氢化物中最不稳定的是HI,所以以极性键相结合,分子最不稳定的是HI,故答案为:HI.
点评 本题考查极性键和非极性键,熟悉常见元素之间的成键是解答本题的关键,注意化学键、空间构型与分子的极性的关系来分析解答即可,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
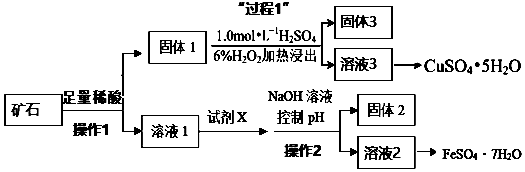
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 8g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 17g氨气所含电子数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
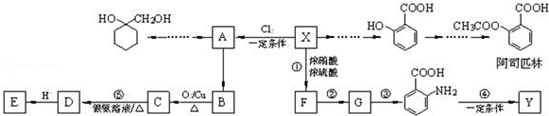
 $\stackrel{MnO(H)}{→}$
$\stackrel{MnO(H)}{→}$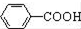
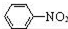 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$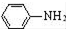 (苯胺,易被氧化)
(苯胺,易被氧化) .
.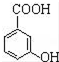 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: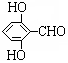 、
、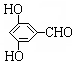 .
.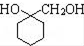 的流程图:
的流程图: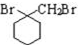 $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$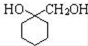
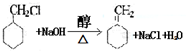 .
.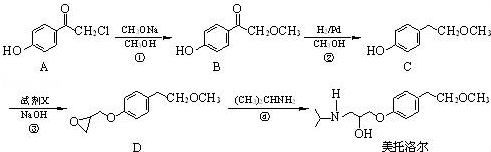
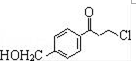 为原料制备
为原料制备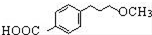 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
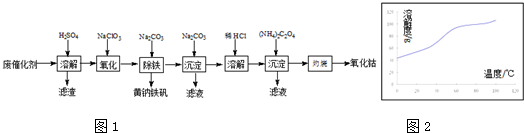
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | B. | 氨气分子的球棍模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 硫化氢分子的电子式: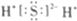 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
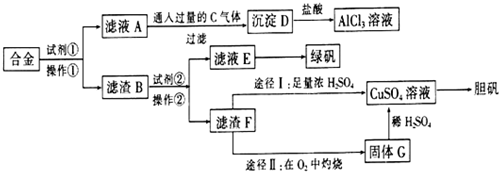
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com