
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 纯水的电离方程式:H2O+H2O?H3O++OH- |
分析 A.燃烧热的热化学方程式中,生成水的状态应该为液态;
B.合成氨的反应为可逆反应,则反应物部分转化成生成物,所以0.5mol氨气完全反应放出热量大于19.3kJ;
C.碳酸根离子的水解分步进行,主要以第一步为主,离子方程式写出第一步的水解即可;
D.水为弱电解质,能够水解生成水合氢离子和氢氧根离子.
解答 解:A.甲烷的燃烧热为890.3kJ•mol-1,则甲烷正确的燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,故A错误;
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),由于该反应为可逆反应,则0.5mol氮气完全反应放热大于19.3kJ,1mol氮气完全反应放出热量大于38.6kJ,故B错误;
C.向Na2CO3溶液中,碳酸根离子水解,溶液呈碱性,则滴入酚酞溶液,溶液变红,正确的离子方程式为:CO32-+H2O?HCO3-+OH-,故C错误;
D.纯水的电离方程式为:H2O+H2O?H3O++OH-,故D正确;
故选D.
点评 本题考查了离子方程式、化学方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握化学方程式、离子方程式的书写原则,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业上用电解熔融氯化镁制单质镁 | |
| B. | 工业上用电解饱和食盐水制氯气 | |
| C. | 工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅 | |
| D. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
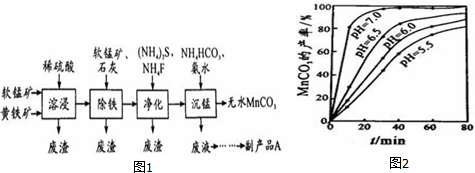
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
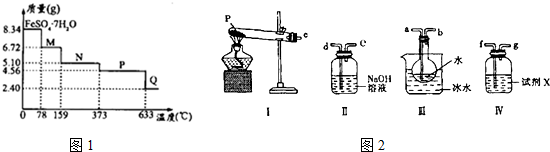
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向氯化铝溶液中加入过量的氨水 | |
| B. |  向饱和石灰水中通入过量的CO2气体 | |
| C. |  向MgCl2、AlCl3的混合液中逐滴加入NaOH溶液至过量 | |
| D. |  向含少量NaOH的偏铝酸钠溶液中通入过量的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+→Ag+→H+ | B. | Ag+→Ba2+→H+ | C. | H+→Ba2+→Ag+ | D. | H+→Ag+→Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.6 mol•L-1 | D. | 0.8 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com