
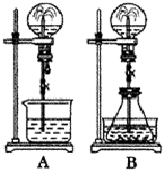
 喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:
喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:分析 (1)依据形成喷泉的条件是烧瓶中的气压变小的要求分析解答即可;
(2)依据加入的物质能导致锥形瓶中气压变大的原理才能产生喷泉的知识分析解答;
(3)在图B锥形瓶外放一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的物质,结果也产生了喷泉,就必须要求水槽中加入的物质后能使锥形瓶中的温度明显升高.
解答 解:(1)该装置中形成喷泉的条件是烧瓶中的气压变小,可以是烧瓶中的气体减少或者是烧瓶中的温度减小等原因造成;
A.HCl和H2O,氯化氢极易溶于水中,能够使烧瓶中的气体体积减小,所以能够形成喷泉,故A错误;
B.Cl2和NaOH溶液,氯气能够与氢氧化钠溶液反应,能使烧瓶中的气体减小,所以能够形成喷泉,故B错误;
C.HCl和汽油,HCl不溶于汽油,所以不能使烧瓶中的气体减小,无法形成喷泉,故C正确;
D.CO2和NaOH溶液能迅速反应,能导致烧瓶中的气体减小,所以能形成喷泉,故D错误;
故答案为:C;
(2)图B是在锥形瓶中加入的物质能导致锥形瓶中气压变大才能形成喷泉,
A.Cu与稀盐酸不反应,所以不能导致锥形瓶中的气压变大,无法形成喷泉,故A错误;
B.碳酸氢钠和NaOH溶液能反应,但不能导致锥形瓶中的气压变大,故B错误;
C.CaCO3与稀硫酸反应生成硫酸钙,硫酸钙为微溶物,阻止了反应继续进行,所以无法形成喷泉,故C错误;
D.碳酸氢铵与稀盐酸反应生成二氧化碳气体,能导致锥形瓶中的气压变大,所以能够形成喷泉,故D正确;
故答案为:D;
(3)A.浓硫酸溶于水放出大量的热使酒精蒸发产生大量酒精蒸气,使锥形瓶内压强大大增加,可以形成喷泉,故A错误;
B.生石灰与水反应生成氢氧化钙,反应放出大量的热,可以使锥形瓶中压强增大,所以能够形成喷泉,故B错误;
C.硝酸铵与乙醇不反应,不能导致锥形瓶中压强增大,无法形成喷泉,故C正确;
D.烧碱溶于水中放出大量的热量,导致锥形瓶中温度升高,压强增大,所以能够形成喷泉,故D错误;
故答案为:C.
点评 本题通过喷泉实验原理考查氨气的化学性质,题目难度中等,注意明确形成喷泉原理,熟练掌握氨气的化学性质,试题培养了学生灵活应用基础知识的能力.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
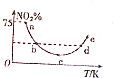 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )| A. | 10s内,图中a点对应的N2O4反应速率为0.01mol•L-1•s-1 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | c点前后平衡移动的方向相反 | |
| D. | e点对应的容器中气体颜色最深 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度,2N2O4(g)═4NO2(g)的反应热和化学平衡常数分别为-2△H和K2 | |
| B. | 该反应达到平衡后,缩小容器的容积,平衡右移,混合气体颜色变浅 | |
| C. | 若投入2mol NO2,通过控制外界条件,必能生成1mol N2O4 | |
| D. | 平衡时一定有v正(NO2)=2v逆(N2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从碘水中萃取碘单质,可用苯做萃取剂 | |
| B. | 用加热分解的方法可以区别碳酸钠和碳酸氢钠两种固体 | |
| C. | 配制一定物质的量浓度的NaCl溶液时,只需使用1次玻璃棒 | |
| D. | 氨气喷泉实验时,烧瓶必须干燥才可收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C、N、P | B. | N、O、S | C. | N、P、F | D. | Be、O、S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com