
【题目】Ⅰ.某微粒的结构示意图为![]() ,试回答:
,试回答:
(1)当y=8时,该粒子可能是_____、_____(分别写出一种阳离子和一种阴离子)。
(2)当x-y=10时,该粒子为_______(选填“原子”或“阳离子”、“阴离子”)。
(3)请写出工业上制取y=7元素对应单质的化学方程式:________________。
Ⅱ.现有 ①BaCl2晶体 ②金刚石 ③碘片 ④干冰 ⑤二氧化硅 ⑥氢氧化钾 ⑦钠 七种物质,请按下列要求回答(填序号):
(1)属于只含离子键的离子晶体的是____________(填序号,下同)。
(2)属于分子晶体的单质是__________。
(3)属于原子晶体的化合物是___________。
【答案】K+ 或Ca2+、 Cl- 或S2- 或P3- 原子 2NaCl + 2H2O![]() 2NaOH + Cl2↑+ H2↑ ① ③ ⑤
2NaOH + Cl2↑+ H2↑ ① ③ ⑤
【解析】
Ⅰ.(1) y=8时,微粒的电子层结构与稀有气体Ar相同,可能是阴离子也可能是阳离子或者是Ar原子的结构示意图,根据具有相同的核外电子排布结构的元素在周期表中的位置关系解答;
(2)根据微粒结构示意图分析电子数和质子数的关系确定粒子的种类;
(3) y=7元素对应单质为Cl2,依据工业上制备氯气可用电解饱和食盐水写出化学方程式。
Ⅱ.①BaCl 2 属离子晶体,只含离子键; ②金刚石属原子晶体,只含共价键; ③碘片属分子晶体,只含共价键,分子间靠范德华力结合;④干冰属分子晶体,只含共价键,分子间靠范德华力结合; ⑤二氧化硅属原子晶体,只含共价键;⑥KOH属离子晶体,含离子键、共价键; ⑦钠属金属晶体,含金属键,以此解答。
Ⅰ.(1)具有相同的核外电子排布结构的元素在周期表中的位置关系遵循“阴上阳下“的规律,核外电子数有18个的微粒阳离子有:K+ 或Ca2+,阴离子有:Cl- 或S2- 或P3-;
因此,本题正确答案是:K+ 或Ca2+;Cl- 或S2- 或P3-;
(2)根据结构示意图可以知道,该微粒核内质子数为:x ,核外电子数为:10+y,因为x-y=10,所以质子数等于电子数,微粒是呈电中性的原子,
因此,本题正确答案是:原子;
(3 )y=7元素对应单质为Cl2,依据工业上制备氯气可用电解饱和食盐水,反应的化学方程式为:2NaCl + 2H2O ![]() 2NaOH + Cl2↑+ H2↑,
2NaOH + Cl2↑+ H2↑,
因此,本题正确答案是:2NaCl + 2H2O ![]() 2NaOH + Cl2↑+ H2↑;
2NaOH + Cl2↑+ H2↑;
Ⅱ.(1)根据以上分析知,属于离子晶体的是①⑥;只有离子键的物质是①,
故答案为:①;
(2)属于分子晶体的是③④,属于分子晶体的单质是③,
故答案为:③;
(3)属于原子晶体的是②⑤,属于原子晶体的化合物是⑤,
故答案为:⑤。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是元素周期表的另一种画法——塔式周期表,在上面标有部分族及部分元素。请回答下列问题:
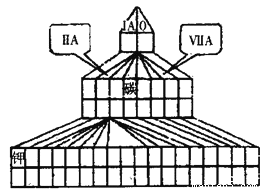
(1)请在图上把过渡元素涂黑。_______
(2)已知A、B、C、D、E、F、G为元素周期表中短周期主族元素,且原于序数依次增大。A与E、D与F分别同主族,E、F、G同周期;A与D形成的化合物常温下为液态;B原子最外层电子数是次外层电子数的两倍。请回答下列问题:
①在如图塔式周期表相应位置标出上述属于碱金属和卤族元素的元素符号。____
②写出E与D形成含有非极性键化合物的电子式 ______。
③这些元素形成的最简单氢化物中,属于18电子的分子有____(写化学式)
④A、D的单质和A、D、E形成的离子化合物的水溶液,在一定条件下可构成原电池,其中D的单质在___极发生反应,原电池反应中,A单质发生反应的电极反应式为_______这种电池相对于其它电池的优点是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重水(D2O)是重要的核工业原料,下列说法错误的是
A.H2O与D2O互称同素异形体B.1H与D互称同位素
C.氘(D)原子核外有1个电子D.1H2与D2的化学性质几乎相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)(3)(4)图中分别有OA<AB,OA=AB,OA>AB,

则下列分析与判断不正确的是
A、M中只有一种溶质的有(1)和(3)
B、M中有两种溶质的有(2)和(4)
C、(2)图显示M中c(NaHCO3)<c(Na2CO3)
D、(4)图显示M中的溶质为NaOH和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血药品的重要成分.某化学兴趣小组同学采用以下方法测定某绿矾样品纯度。实验步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
(1)a步骤中定容时,如果仰视会使所配溶液浓度___________(填“偏高”、“偏低”或“无影响”)。
(2)滴定时盛放KMnO4溶液的仪器为______(填仪器名称)。
(3)判断此滴定实验达到终点的方法是_______________。
(4)写出酸性高锰酸钾滴定Fe2+的离子反应方程式:_____________。
(5)计算上述样品中FeSO4·7H2O的质量分数为________(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,0.01mol/L CH3COOH溶液中c(H+)=4.32×10-4mol/L,则该CH3COOH溶液中水的离子积常数为( )
A.<1×10-14B.>1×10-14C.=1×10-14D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com