
将16mL NO和NH3的混合气体在催化剂作用下,400℃左右发生下列反应:6NO+4NH3⇌5N2+6H2O(g).已知反应达平衡后,在相同条件下混合气体的体积变为17mL,则在原混合气体中,NO和NH3的物质的量之比可能是 ( )
①3:1②3:2③3:3 ④3:4⑤3:5.
|
| A. | ①② | B. | ①⑤ | C. | ②③④ | D. | ④⑤ |
| 化学平衡的计算.. | |
| 专题: | 化学平衡专题. |
| 分析: | 依据反应前后气体体积增大计算气体体积,气体体积之比等于物质的量之比分析计算原混合气体组成, 6NO+4NH3⇌5N2+6H2O△v增大 6 4 5 6 1 6ml 4ml 5ml 6 ml (17﹣16)ml 反应后NO和NH3的混合气体中剩余的气体16ml﹣6ml﹣4ml=6ml, 若剩余NO则原混合气体中NO体积为6ml+6ml=12ml,NH3的体积4ml,在原混合气体中NO和NH3的物质的量之比=12:4=3:1; 若剩余NH3 则原混合气体中NH3的体积=4ml+6ml=10ml,NO为6ml,在原混合气体中NO和NH3的物质的量之比=6:10=3:5. |
| 解答: | 解:6NO+4NH3⇌5N2+6H2O△v增大 6 4 5 6 1 6ml 4ml 5ml 6 ml (17﹣16)ml 反应后NO和NH3的混合气体中剩余的气体16ml﹣6ml﹣4ml=6ml, 若剩余NO则原混合气体中NO体积为6ml+6ml=12ml,NH3的体积4ml,在原混合气体中NO和NH3的物质的量之比=12:4=3:1; 若剩余NH3 则原混合气体中NH3的体积=4ml+6ml=10ml,NO为6ml,在原混合气体中NO和NH3的物质的量之比=6:10=3:5; 所以,NO和NH3的物质的量之比3:1或3:5, 故选B. |
| 点评: | 本题考查了化学平衡计算应用,注意体积变化的计算分析判断,掌握方法是关键,题目难度中等. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
分子式为C8H16O2的有机物A,能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A可能的结构有( )。
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
含铁化合物A电池,具有储能密度大、体积小、重量轻、寿命长、高电压、高容量、无污染等优点,在电子与国防工业中潜在的应用不断扩展。
为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。过程如下:
Ⅰ、经组成分析,该粉末仅含有O、K、Fe三种元素。
Ⅱ、溶解实验:化合物A极易溶于水,但静置一段时间后转化为红褐色沉淀,同时产生一种气体单质。
Ⅲ、定量实验:取3.96g化合物A的粉末溶于水,滴加足量稀硫酸,一段时间后再加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 。
(2)化合物A可作为一种“绿色高效多功能”水处理剂,可由FeCl3和KClO在强碱性条件下反应制得,其反应的离子方程式为 。
(3)化合物A还可以作为高容量电池材料,与MnO2-Zn电池类似,A-Zn也可以组成碱性电池,A在电池中作为正极材料,该电池总反应的离子方程式为___ ____。
(4)请用离子方程式表示化合物A溶于水后的变化 。查阅资料发现,加入下列物质中的___ ____可提高A在水溶液中的稳定性。
A.碳酸钠 B.苯酚钠 C.Fe(NO3)3 D.KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
分析推理是化学学习方法之一.下列实验推理中,正确的是( )
|
| A. | 灼热的铂丝与 NH3、O2混合气接触,铂丝保持红热,说明氨的氧化反应是放热反应 |
|
| B. | 某雨水的pH小于5.6,说明雨水中一定溶解了SO2 |
|
| C. | 某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中一定含有CO32﹣ |
|
| D. | 将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明镁比铝活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E、F是含有同一种元素的化合物,工业生产C的过程中有有一个步骤为F经催化氧化生成B和H2O,它们之间能发生如下反应
①A+H2O→B+C ②C+F→D ③D+NaOH F+E+H2O
F+E+H2O
(1)写出下列物质的化学式:A 、D 、
(2)写出反应①的离子方程式,并指出反应①的氧化剂和还原剂
、氧化剂 、还原剂 .
(3)写出F经催化氧化生成B和H2O的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为
。
② 乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是
乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是
。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
 为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKM nO4标准溶液装入50mL 中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
nO4标准溶液装入50mL 中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
查看答案和解析>>
科目:高中化学 来源: 题型:
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
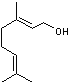
下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色 D.能发生加成反应不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
苯的结构式可用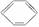 来表示,下列关于苯的叙述中正确的是( )
来表示,下列关于苯的叙述中正确的是( )
A.苯主要是以石油为原料而获得的一种重要化工原料
B.苯中含有碳碳双键,所以苯属于烯烃
C.苯分 子中6个碳碳键完全相同
子中6个碳碳键完全相同
D.苯可以与溴水、高锰酸钾溶液反应而使它们褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com