
����Ŀ��I.ijѧϰС���������ͼװ����ȡSO2���о������ʣ�����һ��̽����ͬŨ�������������

��ش��������⣺
(1)B��C��D�ֱ����ڼ���SO2�����ʣ�д��C�з�Ӧ�����ӷ���ʽ________________��
(2)ʵ���й۲쵽D���л��dz��֣���ͬѧ�����������֤��SO2���������ԡ�
��������ɣ�______________________________________________��
(3)Eװ�õ�����Ϊ_____________________________��
��.ijѧϰС����Ʋ��������ʵ�飺��ȡһ�����Ļ�ԭ���۷���һ�������Ũ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y�������飬����Y�к���SO2��H2��
(4)��ҺX��һ���������еĽ�����������___________��������μ�����ҺX�и�����______________________��
(5)Ϊ�˲ⶨ����Y��SO2�ĺ�������2.24L(��״��)����Yͨ�뵽200.00mL 0.2000mol/L���Ը��������Һ�У���ַ�Ӧ��ȡ��20.00mL��Һת����ƿ�н��еζ�������Ũ��Ϊ0.0500mol/L��KHC2O4��Һ20.00mL��
�������£�0.05mol/L KHC2O4��Һ�У�c(C2O42-)>c(H2C2O4)���ζ�����ʱ����ҺӦװ��
___________(����������)�У��ζ��յ������Ϊ______________________________��
������Y��SO2�����ʵ�������Ϊ____________________��
���𰸡� ![]() װ��C�ӷ���������Ҳ����ʹDװ���г��ֻ��� β������������ Fe2+ ȡ������Һ�����еμ�K3[Fe��CN��3]��Һ��������ɫ������֤��ԭ��Һ�к���Fe2+ ��ʽ�ζ��� �������һ��KHC2O4��Һ��ƿ����Һ����ɫ��Ϊ��ɫ��������ɫ���ָ� 90��
װ��C�ӷ���������Ҳ����ʹDװ���г��ֻ��� β������������ Fe2+ ȡ������Һ�����еμ�K3[Fe��CN��3]��Һ��������ɫ������֤��ԭ��Һ�к���Fe2+ ��ʽ�ζ��� �������һ��KHC2O4��Һ��ƿ����Һ����ɫ��Ϊ��ɫ��������ɫ���ָ� 90��
��������(1) C�б�����ˮ���������Ӧ������������ᣬ��Ӧ�����ӷ���ʽΪ![]() ��(2) װ��C�ӷ���������Ҳ������Dװ���г��ֻ��ǣ���ʵ���й۲쵽D���л��dz��֣�����֤��SO2���������ԣ�(3)������������Ⱦ���壬����ֱ���ŷŵ������У����ð������գ�Eװ�õ�����Ϊβ��������������(4)���ŷ�Ӧ�Ľ��У�����Ũ�Ƚ��ͣ����������庬����������һ����������ϡ���ᷴӦ�������������������ķ�Ӧ������ҺX��һ���������еĽ�����������Fe2+��������ҺX��Fe2+�ķ�����ȡ������Һ�����еμ�K3[Fe��CN��3]��Һ��������ɫ������֤��ԭ��Һ�к���Fe2+��(5) �ٱ���ҺKHC2O4��Һ�У�c(C2O42-)>c(H2C2O4)������Һ�����ԣ��ζ�����ʱ����ҺӦװ����ʽ�ζ����У��ζ��յ������Ϊ�������һ��KHC2O4��Һ��ƿ����Һ����ɫ��Ϊ��ɫ��������ɫ���ָ����ڸ��ݷ�Ӧ2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+��2MnO4-+5HC2O4-+3H+=2Mn2++10CO2��+2H2O��֪�������������ĵĸ�����ص����ʵ���Ϊ0.2L��0.2000mol/L-
��(2) װ��C�ӷ���������Ҳ������Dװ���г��ֻ��ǣ���ʵ���й۲쵽D���л��dz��֣�����֤��SO2���������ԣ�(3)������������Ⱦ���壬����ֱ���ŷŵ������У����ð������գ�Eװ�õ�����Ϊβ��������������(4)���ŷ�Ӧ�Ľ��У�����Ũ�Ƚ��ͣ����������庬����������һ����������ϡ���ᷴӦ�������������������ķ�Ӧ������ҺX��һ���������еĽ�����������Fe2+��������ҺX��Fe2+�ķ�����ȡ������Һ�����еμ�K3[Fe��CN��3]��Һ��������ɫ������֤��ԭ��Һ�к���Fe2+��(5) �ٱ���ҺKHC2O4��Һ�У�c(C2O42-)>c(H2C2O4)������Һ�����ԣ��ζ�����ʱ����ҺӦװ����ʽ�ζ����У��ζ��յ������Ϊ�������һ��KHC2O4��Һ��ƿ����Һ����ɫ��Ϊ��ɫ��������ɫ���ָ����ڸ��ݷ�Ӧ2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+��2MnO4-+5HC2O4-+3H+=2Mn2++10CO2��+2H2O��֪�������������ĵĸ�����ص����ʵ���Ϊ0.2L��0.2000mol/L- ![]() ��10��0.05000mol/L��0.02L=0.036mol������Y��SO2�����ʵ�������Ϊ
��10��0.05000mol/L��0.02L=0.036mol������Y��SO2�����ʵ�������Ϊ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ��ѡ��5���л���ѧ����] AΪij�־ۼ���ϩ�����ĵ��壬��ת����ϵ���£�

��֪��E��G�ı�����һ�ȴ���ֻ�����֣�
II��RCH=CH2+HBr![]() RCH2CH2Br
RCH2CH2Br
�밴Ҫ��ش��������⣺
��1��A�Ľṹ��ʽΪ______, �ڵķ�Ӧ����_____________��
��2��B�й����ŵĽṹΪ_____________��H������____________��
��3��D���Է������۷�Ӧ����Ӧ�Ļ�ѧ����ʽΪ____________��
��4��д��ͬʱ��������������G��ͬ���칹����_______��
���ܷ���������Ӧ �ڱ����ϵ�һ��ȡ����������
���к˴Ź����������֮��Ϊl:2:2:2:l������FeCl3��Һ����ɫ�Ļ�����Ľṹ��ʽΪ______
��5����BΪԭ�Ϻϳɺ���Ԫ�����������ʣ�����ƺϳ�·�ߣ�������ͼ��ʾ�����Լ���ѡ�����ϳ�����ͼʾ�����£�![]() ____
____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ���õ��Լ�����ҵ�������̿��Ʊ���������������¡�
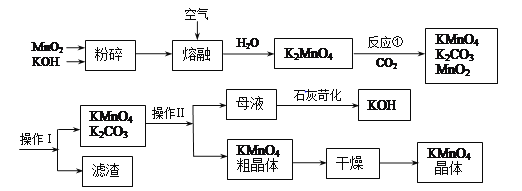
��1��������(NaBiO3,������ˮ)���ڶ��Լ���������Һ��Mn2+�Ĵ���(��Ļ�ԭ����ΪBi3+��Mn����������Ϊ+7��)��д����Ӧ�����ӷ���ʽ__________��
��2��KMnO4ϡ��Һ��һ�ֳ��õ���������������ԭ��������������ͬ����________(�����)��
a��84����Һ(NaClO��Һ) b��˫��ˮ c��75%�ƾ� d������ˮ
��3�����������п���ѭ��ʹ�õ�������________��________(д��ѧʽ)��
��4��������(������������ѭ�����Ʊ������е���ʧ)1molMnO2���Ƶ�________molKMnO4��
��5����������������________;����������KMnO4��K2CO3���������ܽ���ϵIJ��죬����________(���������)�����ȹ��˵õ�KMnO4�־��塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣����ݱ��и�����10��Ԫ�أ��ش��������⣮
���� �� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
��1�����ʵĻ�ѧ�������o��Ԫ������
��2������ԭ�ӽṹʾ��ͼ����
��3���γɻ�������������Ԫ������
��4��HF��H2O�У����ȶ��Խ�ǿ������
��5��N��P�У�ԭ�Ӱ뾶��С������
��6�������£�����Ũ�����з����ۻ��Ľ�������
��7��Ԫ������������Ӧˮ�����У�������ǿ�������ѧʽ����������ǿ�������H2SO4����HClO4������
��8�����һ���������ʹƷ����Һ��ɫ��д����������Ļ�ѧʽ �� ������Ԫ�غ���Ԫ�ص�������m��S����m��O��= �� �����ԭ��������S��32��O��16��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ��γ���������������ĺ����塢�߶�����������嶼�йأ��� ��
A. Ѫ�쵰�� B. ��������ø C. θ����ø D. �Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ÿ����Ա��μ���SO42-���ӵĴ���ʱ�����ڴ�����Һ�м������ᣬ�������� �� ��
A.�γɽ϶�İ�ɫ����B.�ų�SO42-��������������Ӽ�Ag+�ĸ���
C.�γɵij������ȸ���D.�ų�Ba2+��������������ӵĸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���ϡ������ij������Ӧ��ʵ������:
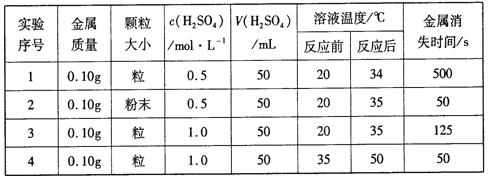
�����������ݣ��ش���������:
��1��ʵ��1��2����,_____�Է�Ӧ������Ӱ��;ʵ��1��3������______�Է�Ӧ������Ӱ�졣
��2��������,����ȫ��ͬ��пƬ�ֱ�Ͷ��100mL0.1mol/L��ϡ�����100mL0.2mol/L��ϡ������,��ϸ�۲���֣����߷�Ӧ���������Բ���:Ͷ�뵽ϡ�����е�п�������������û��Ͷ�뵽ϡ�����еĿ������������۴����Ϊ������һ�����ԭ�������ֿ���:
a�������ӶԷ�Ӧ���˴ٽ����ã��������Ӽӿ��˷�Ӧ�Ľ�����
b��____(��Ĺ۵�)��
Ҫ֤����Ĺ۵�,���������������ֱ�ȡ100mL0.1mol/L��������Һ��������ͬ���ձ��У�һ���ձ��м�һ������____����(�������Լ���ѧʽ),��һ���ձ����Ա�ʵ�����ٷֱ�ͬʱ������ȫ��ͬ��пƬ,�Ƚ����ձ��з�Ӧ���ʵĴ�С��
��3������п����ϡ���ᷴӦ��ȡ����ʱ��������������CuSO4��ĩ���ɼӿ����H2����������ԭ����_________(�����ֱ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԷǽ���Ԫ��(��ϡ������Ԫ����)������ж���ȷ����( )
��������������4��Ԫ�ؾ�Ϊ�ǽ���Ԫ��
�ڵ����ڷ�Ӧ�ж�ֻ����������
�۷ǽ���Ԫ�ض�������Ԫ��
�������ﳣ���¶�������ˮ��Ӧ������
�ݢ�A��Ԫ����ͬ�����зǽ�������ǿ��Ԫ��
A.�ڢ�B.�ۢ�C.�ڢۢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ϸ���Ļ�ѧԪ��˵����ȷ����
A. ֲ��ϸ���к�����������Ԫ����C��H��O��N
B. ��Ԫ���������ٶ��������Ԫ����Ҫ
C. ϸ����ij�ֱ���Ԫ�ؿɱ�����Ԫ�����
D. ���DNA��RNA��Ԫ�����ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com