
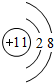 ,故答案为:H;Na;
,故答案为:H;Na;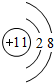 ;
;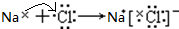 ,故答案为:
,故答案为: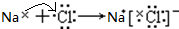 ;
;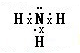 ,故答案为:
,故答案为: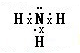 .
.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B两种固体物质的溶解度曲线如图所示.请回答:
A、B两种固体物质的溶解度曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃,NaHCO3在水中的溶解度比Na2CO3的小 |
| B、Na2O和Na2O2中的阴阳离子个数比不相等 |
| C、用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色说明原溶液中有Na+无K+ |
| D、Na与足量O2反应,随温度升高生成Na2O的速率逐渐加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4 |
| B、[H+]=1×10-3mol?L-1 |
| C、[OH-]=1×10-12mol?L-1 |
| D、[OH-]=1×10-14mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cl-、Al3+、SO42- |
| B、Na+、NH4+、NO3-、CO32- |
| C、Fe2+、NO3-、SO42-、Mg2+ |
| D、Na+、SO42-、K+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| B、钠与水反应:Na+2H2O=Na++OH-+H2↑ |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、铝片放入氢氧化钠溶液中:2Al+2H2O+2OH-=2AlO2-+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com