
| A. | AlCl3 | B. | Cu(NO3)2 | C. | FeSO4 | D. | Na2CO3 |
分析 如果溶质在加热过程中不分解、不水解生成易挥发的物质就能得到原溶液中的溶质,据此分析解答.
解答 解:A.加热氯化铝溶液时,氯化铝水解生成氢氧化铝和HCl,HCl具有挥发性,加热促进其挥发,所以蒸干时得到的固体是氢氧化铝,故A错误;
B.加热硝酸铜溶液时,硝酸铜水解生成氢氧化铜和硝酸,硝酸具有挥发性,加热促进其挥发,所以蒸干时得到的固体是氢氧化铜,故B错误;
C.硫酸亚铁易被氧化为硫酸铁,三价铁水解为氢氧化铁和硫酸,硫酸不挥发,二者继续反应生成硫酸铁,即最后得到硫酸铁,故C错误;
D.碳酸钠在溶液在加热时水解得到碳酸氢钠与氢氧化钠,但氢氧化钠和碳酸氢钠难挥发,最后又重新得到的固体Na2CO3,所以能得到原溶质,故D正确;
故选D.
点评 本题考查盐类水解的应用,为高频考点,侧重学生的分析能力的考查,题目难度不大,注意盐类水解的原理,特别是把握相关物质的性质.


科目:高中化学 来源: 题型:选择题
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol Al与足量盐酸反应转移电子数为1NA | |
| B. | 500mL 1mol/LNa2CO3溶液中,含有Na+离子数目为NA | |
| C. | 常温常压下,11.2LO2(g)中含有O2分子数目为0.5NA | |
| D. | 标准状况下,11.2 L H2O所含的分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式盐的水溶液一定显酸性 | |
| B. | 只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性 | |
| C. | 纯水呈中性是因为水中c(H+)和c(OH-)相等 | |
| D. | NaHCO3与Na2SO4溶液的混合溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)5Cl]Cl2•H2O | ||
| C. | [Cr(H2O)4Cl2]Cl•2H2O | D. | [Cr(H2O)3Cl3]•3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO (g)+2H2 (g)═CH3 OH(g) | △H1=-90.8kj/mol | k1=160(mol/L)-2 |
| ②CO2 (g)+H2 (g)═CO (g)+H2 O(g) | △H2=-41.2kj/mol | K2 |
| ③3H2 (g)+CO2 (g)═H2 O(g)+CH3 OH(g)△H 3 | △H3 | K3=160(mol/L)-2 |
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |
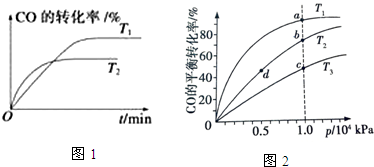
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
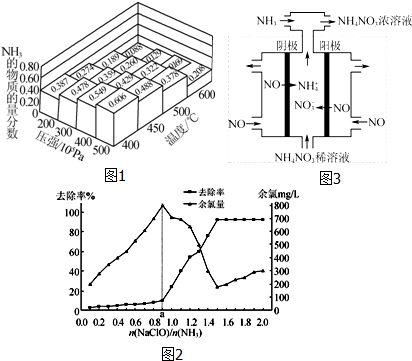
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,46g NO2和N2O4含有2NA个氧原子 | |
| B. | 1mol Na中约含NA个电子 | |
| C. | 4gNaOH中含有NA个OH- | |
| D. | 标况下,22.4LHF中含有NA个HF分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com