
| A. | 常温常压下,等质量的N2和CO气休的原子数均为2NA | |
| B. | 在反应KC1O4+8HCI=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA | |
| C. | 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA | |
| D. | 标准状况下,80gSO3中含3NA个氧原子,体积约为22.4L |
分析 A.缺少氮气和NO的质量,无法计算含有原子数;
B.反应中生成4mol氯气转移了7mol电子;
C.过氧化钠的化学式中含有3个离子,则含有3mol离子的过氧化钠固体的物质的量为1mol,1mol过氧化钠与水反应生成0.5mol氧气,转移了1mol电子;
D.标准状况下,三氧化硫的状态不是气体.
解答 解:A.等质量的N2和CO具有相同的物质的量,没有告诉具体质量,则无法计算二者含有原子数,故A错误;
B.反应KClO4+8HCl=KCl+4Cl2↑+4H2O中生成4mol氯气转移了7mol电子,则每生成4molCl2转移的电子数为7NA,故B错误;
C.含有3mol离子的过氧化钠固体的物质的量为1mol,1mol过氧化钠和足量的水反应生成0.5mol氧气,转移电子的物质的量为1mol,电子转移数为NA,故C正确;
D.标况下三氧化硫不是气体,不能使用标况下的气体摩尔体积计算三氧化硫的体积,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的计算与判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件为解答关键,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:推断题
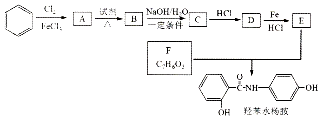
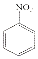 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$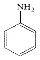
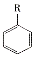 (R-烷基)$\stackrel{KMnO_{4}/H+}{→}$
(R-烷基)$\stackrel{KMnO_{4}/H+}{→}$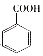
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$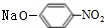 +NaCl+H2O.
+NaCl+H2O.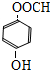 .
.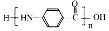 的合成路线
的合成路线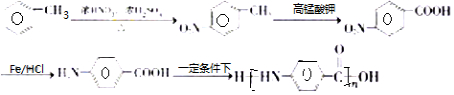 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,22.4升的H2O含有的水分子数为NA | |
| B. | 标况下,11.2升CCl4中含有的Cl原子数为2NA | |
| C. | 17克NH3中含有的电子总数为10NA | |
| D. | 0.5mol/L的H2SO4溶液中含有的H+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单斜硫转化为正交硫需要吸热 | B. | 单斜硫比正交硫稳定 | ||
| C. | △H4>△H5 | D. | △H4<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 得到2.54g沉淀时,加入NaOH溶液的体积是600L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
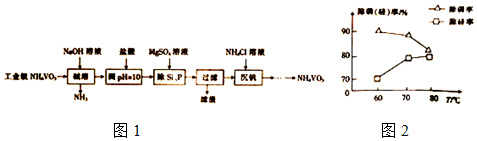
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com