
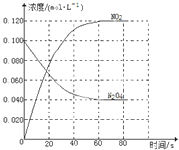
| △c |
| △t |
| 0.06mol/L |
| 60S |
| c2(NO) |
| c(N2O4) |
| (0.12mol/L)2 |
| 0.04mol/L |


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:

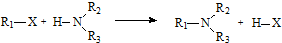 ;
;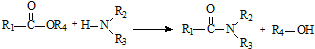 .
. 和
和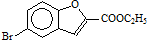 直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式
直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:

| 一定条件 |
| [o] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定存在SO32-离子 |
| B、一定存在CO32-离子 |
| C、一定存在Cl-离子 |
| D、可能存在HCO3-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
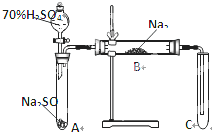 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用下图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用下图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使反应体系的活化能降低 |
| B、使反应体系的活化分子总数增多 |
| C、使反应体系的活化分子百分数降低 |
| D、使反应体系的活化分子百分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或结构 |
| T | M层上有2对成对电子 |
| X | 元素最高正价是+7价 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 单质是银白色固体、导电、密度比水小,与水剧烈反应、和氧气反应不同条件下产物不同 |
| A、T的氢化物是同族元素氢化物中沸点最低的 |
| B、X的最高价氧化物对应的水化物,是无机含氧酸中的最强酸 |
| C、离子半径从小到大的顺序:Y<Z<T<X |
| D、X、Y形成化合物的晶体类型与X、Z形成化合物的晶体类型不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com