
【题目】短周期主族元素X、Y、Z的原子序数依次增大,在周期表中Y分别与X、Z相邻。回答下列问题:
(1)若X、Y和Z的单质都为金属,Y与Z左右相邻,Z的单质被称为“国防金属”。则Y的单质在O2中燃烧产物中含有的化学键为____________________________。
(2)若X、Y和Z位于同一周期,高纯度Y单质常用于制造太阳能电池。则除去Y的氧化物中所含X氧化物杂质的方法是________________过滤、洗涤、干燥。
(3)若X原子最外层电子数是电子层数的2倍,Z与Y同主族,则X、Y、Z的简单气态氢化物中,沸点最高的是________________。(填化学式)
(4)若Y的原子序数等于X的2倍,T是Z的气态氢化物。
①写出Z2X对应的水化物分子的电子式________________。
②M是短周期中原子半径最大的元素,由M、X、Y元素组成的一种化合物与T的水溶液反应产生刺激性气味的气体,溶液变浑浊。写出反应的离子方程式:____________。
【答案】离子键和共价键(答不全不得分) 加入稀硫酸(或盐酸)充分反应(其他合理答案也给分) NH3 ![]() S2O32-+2H+===S↓+SO2↑+H2O
S2O32-+2H+===S↓+SO2↑+H2O
【解析】
(1)Z的单质被称为“国防金属”,Z是Mg,X、Y和Z的单质都为金属,短周期主族元素X、Y、Z的原子序数依次增大,Y与Z左右相邻,Y是Na,则Y的单质在O2中燃烧产物是过氧化钠;
(2)若X、Y和Z位于同一周期,在周期表中Y分别与X、Z相邻,高纯度Y单质常用于制造太阳能电池,Y是Si,X是Al;
(3)若X原子最外层电子数是电子层数的2倍,X是C,Z与Y同主族,Y是N,Z是P,NH3分子间形成氢键;
(4)①若Y的原子序数等于X的2倍, X是O,Y是S,Z是Cl;
②M是短周期中原子半径最大的元素,M是Na,T是Z的气态氢化物,T是HCl,M、X、Y元素组成的一种化合物为Na2S2O3;
(1)Z的单质被称为“国防金属”,Z是Mg,X、Y和Z的单质都为金属,短周期主族元素X、Y、Z的原子序数依次增大,Y与Z左右相邻,Y是Na,则Y的单质在O2中燃烧产物是过氧化钠,过氧化钠中既有离子键又有共价键,故答案为:离子键和共价键;
(2)若X、Y和Z位于同一周期,在周期表中Y分别与X、Z相邻,高纯度Y单质常用于制造太阳能电池,Y是Si,X是Al,二氧化硅不溶于稀硫酸(或盐酸),氧化铝溶于稀硫酸(或盐酸),故答案为:加入稀硫酸(或盐酸)充分反应;
(3)若X原子最外层电子数是电子层数的2倍,X是C,Z与Y同主族,Y是N,Z是P,NH3分子间形成氢键,沸点最高,故答案为:NH3;
(4)①若Y的原子序数等于X的2倍, X是O,Y是S,Z是Cl, 所以Z2X对应的水化物是次氯酸,电子式为: ![]() ,故答案为:
,故答案为:![]() ;
;
②M是短周期中原子半径最大的元素,M是Na,T是Z的气态氢化物,T是HCl,M、X、Y元素组成的一种化合物为Na2S2O3,与盐酸反应的离子方程式为:S2O32-+2H+===S↓+SO2↑+H2O;故答案为:S2O32-+2H+===S↓+SO2↑+H2O;


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】SO2的含量是衡量大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3 kJ /mol和-297.2 kJ /mol,则CH4和SO2反应的热化学方程式为 _________________________________________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
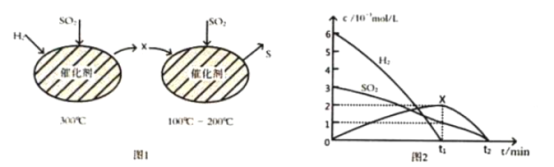
①分析可知X为________(写化学式), 0~t1时间段的温度为_____, 0~t1时间段用SO2表示的化学反应速率为 ___________________________。
②总反应的化学方程式为__________________________________________________________。
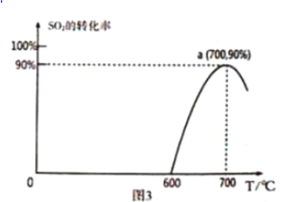
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H _________________________ 0 (填“>”或“<”)
②计算700℃该反应的平衡常数为____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式或离子方程式:
(1)硫酸酸化的高锰酸钾与草酸反应的化学方程式:_____________________________。
(2)硫代硫酸钠与稀硫酸反应的化学方程式:____________________________________。
(3)硫酸酸化的碘化钾溶液与氧气反应的离子方程式:________________________。
(4)K2Cr2O7的溶液中K2Cr2O7与K2CrO4转化的离子方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从精炼钢的阳极泥中(主要成分为Cu2Te)回收碲的工艺流程如下:

请回答下列问题:
(1)“焙烧”后,碲主要以TeO2形式存在,则每生成32gTeO2,反应转移电子的物质的量为____________mol。
(2)为选择最佳焙烧工艺,进行温度和硫酸加入量的条件试验,结果如下表所示:

则实验中应选择的条件为________________________。
(3)“氧化”时的溶液温度不宜过高,原因为________________________。
(4)工艺(I)中,“还原”时发生的总离子方程式为______________________________。H2SO4和Na2SO3可用浓盐酸代替,但缺点为______________________________________。
(5)工艺(II)中,“浸出液电积”时产生碲粉的电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.Na在氧气中燃烧主要生成Na2O
B.将SO2通入BaCl2溶液可生成BaSO3沉淀
C.将CO2通入次氯酸钙溶液可生成次氯酸
D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况(不计CO2的溶解),则下列对应图形的判断正确的是
A. 含有两种溶质 B. 只含有一种溶质
B. 只含有一种溶质 C. 只含有碳酸钠
C. 只含有碳酸钠 D. 有碳酸钠和碳酸氢钠
D. 有碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)一定量的浓硝酸与足量铜完全反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积的O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol.L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL,下列说法正确的是
A. 参加反应的硝酸是0.4mol B. 消耗氧气的体积为1.68L
C. 混合气体中含NO2 1.12L D. 此反应过程中转移的电子为0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在一个10L恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为_________________。
(2)反应开始至2min,以气体X表示的平均反应速率为________________。
(3)平衡时容器内气体的压强与起始时比________________(填“变大”,“变小”或“相等”下同),混合气体的密度与起始时比________________。
(4)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=____。
Ⅱ.在恒温恒压的密闭容器中,当下列物理量不再发生交化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2NO2(g)![]() N2O4(g)达到平衡状态的是________(填序号,下同)。
N2O4(g)达到平衡状态的是________(填序号,下同)。
(2)一定能证明NH2COONH4(s)![]() CO2(g)+2NH3(g)达到平衡状态的是______。
CO2(g)+2NH3(g)达到平衡状态的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.碳酸的电离方程式:H2CO3 ![]() 2H+ + CO32-
2H+ + CO32-
B. 硫化钠水解: S2-+2H2O![]() H2S +2OH-
H2S +2OH-
C.往AgI悬浊液中滴加Na2S饱和溶液:2Ag+ (aq)+ S2-(aq) = Ag2S(s)
D.用醋酸除水垢: 2CH3COOH + CaCO3 = 2CH3COO- + Ca2+ + H2O + CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com