
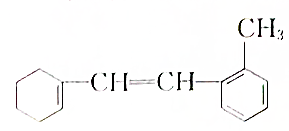 [典型例题√某有机物的结构简式如图:
[典型例题√某有机物的结构简式如图:分析 有机物含有2个碳碳双键,可发生加成、加聚和氧化反应,含有苯环,可发生加成反应和取代反应,以此解答该题.
解答 解:(1)有机物结构不对称,苯环有4种H原子,则苯环上一氯代物有4种,
故答案为:4;
(2)含有2个碳碳双键,可与溴水发生加成反应,则1mol 该物质和溴水混合,消耗Br2的物质的量为 2mol,
故答案为:2;
(3)能与氢气发生加成反应的为碳碳双键和苯环,1mol该物质和H2加成最多需H25mol.
故答案为:5;
(4)A.此物质含碳碳双键可发生加成、甲基、苯环可发生取代反应、碳碳双键可发生氧化反应,故A正确;
B.此物质属于有机物,含有苯环、碳碳双键不溶于水,故B正确;
C.此物质含碳碳双键可发生加成反应,能使溴水褪色,故C正确;
D.该物质能使酸性KMnO4溶液褪色,但发生的是氧化反应,故D错误;
故选D.
点评 本题考查有机物的结构和性质,为高频考点和常见题型,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 核磁共振仪、红外光谱仪、质谱仪、紫外光谱仪、元素分析仪、紫外可见分光光度计等都是定性或定量研究物质组成或结构的现代仪器 | |
| B. | 利用元素周期律,人们在过渡元素中寻找各种性能优良的催化剂,使反应的温度降低并提高反应物的转化率,从而起到很好的节能效果 | |
| C. | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | |
| D. | 分液、蒸馏、渗析、层析及色谱法、钠融法等都是混合体系分离提纯常用的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录:实验后的记录:①Cu为负极,发生氧化反应; ②H+向负极移动; ③Cu电极上有气泡产生;④电子流动方向是Zn→导线→Cu.描述合理的是( )
如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录:实验后的记录:①Cu为负极,发生氧化反应; ②H+向负极移动; ③Cu电极上有气泡产生;④电子流动方向是Zn→导线→Cu.描述合理的是( )| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | Cl-Cl | PCl3中P-Cl键 | PCl5中P-Cl键 |
| 键能/kJ•mol-1 | d | 1.2c | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| Y | ||
| Z |
 ,该分子中含2个σ键,0个π键(若不含填0).
,该分子中含2个σ键,0个π键(若不含填0).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com