
| A. | 过氧化钠 | B. | 碘化氢 | C. | 苛性钠 | D. | 氯化钾 |
分析 活泼金属和活泼金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,为离子化合物,故A错误;
B.HI分子中H-I原子之间只存在极性键,为共价化合物,故B错误;
C.NaOH中钠离子和氢氧根离子之间存在离子键、H-O原子之间存在极性键,为离子化合物,故C正确;
D.KCl中钾离子和氯离子之间只存在离子键,为离子化合物,故D错误;
故选C.
点评 本题考查化学键及化合物类型判断,为高频考点,明确物质构成微粒及微粒之间作用力即可解答,注意过氧化钠中存在的化学键及电子式书写方法,为易错点.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:高中化学 来源: 题型:选择题
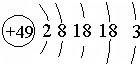 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In为长周期元素 | B. | In的最高正化合价为+3 | ||
| C. | In容易导电导热 | D. | In和铝同主族,金属性比铝弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 | |
| B. | SiO2晶体熔化时破坏的是共价键;所以CO2晶体熔化时破坏的也是共价键 | |
| C. | 可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝 | |
| D. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液盛装在用橡胶塞的试剂瓶中 | |
| B. | 氢氟酸盛装在细口玻璃瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠保存在石蜡油或煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 75% | C. | 60% | D. | 40% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
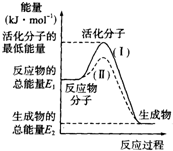 (1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高正价 | +6 | +1 | 无 | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低负价 | -2 | 无 | -2 | 无 | -4 | -3 | -1 | 无 | -3 | -4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com