
| A.H2O2,ZnO | B.氨水 | C.KMnO4,ZnCO3 | D.NaOH溶液 |
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源:不详 题型:填空题
 2Cu+SO2
2Cu+SO2
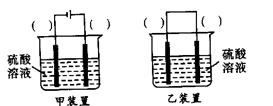
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO2(g)+N2(g),已知该反应的平衡常数极大(570 K时为1×1059),但反应速率极慢。下列说法正确的是
2CO2(g)+N2(g),已知该反应的平衡常数极大(570 K时为1×1059),但反应速率极慢。下列说法正确的是| A.反应中NO作氧化剂,N2是氧化产物 |
| B.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| C.提高尾气净化效率的最佳途径是使用高效催化剂 |
| D.增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化还原反应的本质是有化合价的变化 |
| B.分解反应一定是氧化还原反应 |
| C.利用化合反应可制备FeCl2、Fe(OH)3 |
| D.在一定条件下能向正反两个方向进行的反应称为可逆反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.原子核内有10个中子的氧原子: |
B.氯原子的结构示意图: |
| C.Fe3+的最外层电子排布式为:3s23p63d5 |
D.基态铜原子的外围电子排布图: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质所含元素化合价降低的反应是还原反应 |
| B.金属原子越容易失去电子,其氧化性越强 |
| C.某元素由化合态转化为游离态,该元素一定被氧化 |
| D.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
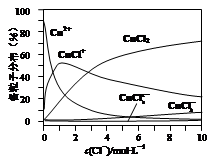
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.氢氧化钠的电子式: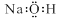 |
B.Cl-的结构示意图: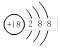 |
C.2-丁醇的结构简式: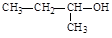 |
| D.碳酸的电离方程式:H2CO3=2H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com