
| A、10mL 0.2 mol?L-1的氨水与10mL 0.1mol?L-1的盐酸充分反应混合后的溶液中,存在:c(NH4+)+c(NH3?H2O)=2c(Cl-)=0.1mol?L-1 |
| B、已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-) |
| C、CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、NaHSO3溶液中一定有:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |


科目:高中化学 来源: 题型:
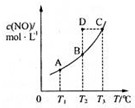 在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)?CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是( )
在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)?CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是( )| A、该反应的△H>0 |
| B、若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
| C、在T2时,若反应体系处于状态D,则这时一定有v正<v负 |
| D、在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系不属于胶体 |
| B、我国航天员穿的航天服使用了高强度、高韧性的特种尼龙,它是一种高分子化合物 |
| C、有机玻璃是以M(甲基丙烯酸甲酯)为单体,通过加聚反应得到的.合成M的一种方法CH3C≡CH+CO+CH3OH→CH2=C(CH3)COOCH3符合绿色化学的要求 |
| D、我国作为燃煤大国,酸雨的危害十分严重,安装烟气脱硫设施进行脱硫,吸收塔内浆液的pH值越高,越不利于SO2的吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棉、麻、丝、合成纤维完全燃烧生成物中都含有CO2和H2O |
| B、日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
| C、兰州水污染苯超标是由于石油泄漏,污染物以烃类为主 |
| D、雾霾天车灯的通路属于丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀的食盐水能杀死H7N9禽流感病毒 |
| B、涤纶、塑料、光导纤维都是有机高分子材料 |
| C、用电镀厂的废水直接灌溉农田,可提高水的利用率 |
| D、外形似海绵、密度小、有磁性的碳与石墨互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第ⅠA族元素都比第ⅡA族元素金属性强 |
| B、只含有非金属元素的化合物可能是离子化合物 |
| C、只含有共价键的物质一定是共价化合物 |
| D、同主族元素原子半径越小越容易失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、L、T形成的简单离子核外电子数相等 |
| B、R的氧化物对应的水化物呈强碱性 |
| C、X单质在氧气中燃烧生成XO3 |
| D、离子半径大小:r(M3+)>r(T2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在食用盐中添加适量的碘酸钾 |
| B、用聚氯乙烯塑料袋包装食品 |
| C、在食品加工中科学使用食品添加剂 |
| D、研发高效低毒的农药,降低蔬菜的农药残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com