
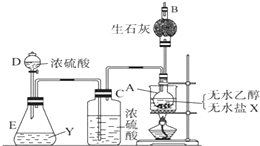
 为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.
为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.分析 因浓盐酸与浓H2SO4混合产生HCl气体,使干燥的HCl气体在装置A中与乙醇发生反应:C2H5OH+HCl$\stackrel{△}{→}$C2H5Cl+H2O,产生的水可使无水CuSO4变蓝,来证明产生的H2O中的氧元素来源于乙醇,而非HCl,达到验证实验的目的.
(1)浓盐酸与浓H2SO4混合产生HCl气体;
(2)浓硫酸具有吸水性,而且吸水放热,浓盐酸具有挥发性;
(3)醇能和氢卤酸发生取代反应得到卤代烃;
(4)乙醇能和氢卤酸发生取代反应得到卤代烃和水,水中的氧原子来自乙醇;
(5)用无水硫酸铜来检验乙醇的反应产物水时,一定要排除干扰因素
解答 解:因浓盐酸与浓H2SO4混合产生HCl气体,使干燥的HCl气体在装置A中与乙醇发生反应:C2H5OH+HCl$\stackrel{△}{→}$C2H5Cl+H2O,产生的水可使无水CuSO4变蓝,来证明产生的H2O中的氧元素来源于乙醇,而非HCl,达到验证实验的目的.
(1)浓硫酸具有吸水性,HCl有挥发性,浓盐酸与浓H2SO4混合会挥发出HCl气体,
故答案为:HCl;
(2)用浓盐酸与浓H2SO4混合,浓硫酸会吸水放热,由于HCl具有挥发性,受热时加速挥发,
故答案为:吸收浓盐酸中混有的水分,浓H2SO4溶于水放热,有利于HCl气体逸出;
(3)乙醇能和氢卤酸发生取代反应,方程式为:C2H5OH+HCl$\stackrel{△}{→}$C2H5Cl+H2O,属于取代反应,CH3CH2Cl名称为:氯乙烷,
故答案为:C2H5OH+HCl$\stackrel{△}{→}$C2H5Cl+H2O;氯乙烷;
(4)实验过程中观察到无水CuSO4由白变蓝,说明反应中有水生成,水中的氧元素不能来自于HCl,故只能由乙醇提供,
故答案为:无水CuSO4变蓝证明了反应中有水生成,水中的氧元素不能来自于HCl,故只能由乙醇提供;
(5)将氯化氢干燥的浓硫酸不能省去,因为HCl挥发时带出水蒸气,若不除去,无法判定使无水CuSO4变蓝的水是否来自于乙醇,
故答案为:否.
点评 本题考查了证明乙醇分子中含有氧原子实验方案的设计,侧重考查乙醇的化学性质,题目难度中等.注意利用取代法结合质量守恒定律确定乙醇所含元素


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | Na与水反应 Na+2H2O=Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-=Al(OH)3↓ | |
| C. | 氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 氢氧化钡溶液与硫酸溶液反应 Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可溶性铁盐、铝盐均可用于水的净化 | |
| B. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 | |
| C. | 电解NaCl溶液可制得金属钠 | |
| D. | 在海轮外壳上镶嵌上锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
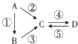 Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.
Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个丙烯分子有8个σ键,1个π键 | |
| B. | 1、4-二甲苯核磁共振氢谱中有两组峰,且氢原子数之比为3:2 | |
| C. | 丙氨酸分子属于手性分子 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| A | 将SO2通入溴水,溴水褪色 | 验证SO2的还原性 |
| B | 将氯水加入淀粉KI溶液中 | 验证Cl非金属性比I强 |
| C | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| D | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )
近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )| A. | 1molAl2H6中约含有4.8×1024个σ键 | |
| B. | 60gAl2H6中含铝原子约为1.2×1023个 | |
| C. | Al2H6可以燃烧,产物为氧化铝和水 | |
| D. | Al2H6在固态时所形成的晶体是离子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com