
(12分)I、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中![]() =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:____________
(3)平衡时,N的转化率为 。
(4)下列叙述中能说明上述反应达到平衡状态的是
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
II、(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1。则燃烧1molH2放出的热量为 kJ。
(2)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放_______kJ的能量。
I、(1)2(2)1/(t2-t1)V mol·(L·min)-1 (3)75% (4)CEF
II:(1)286 (2)632
解析:I、(1)根据图像可知反应进行到t1时N减少了8mol-6mol=2mol,M增加了3mol-2mol=1mol,根据变化量之比是相应的化学计量数之比可知a︰b=2︰1。
(2)t1到t2时刻M的物质的量增加了4mol-3mol=1mol,反应速率通常用单位时间内浓度的变化量来表示,因此以M的浓度变化表示的平均反应速率为![]() 。
。
(3)平衡时N的物质的量减少了8mol-2mol=6mol,所以其转化率是![]() 。
。
(4)M与N的物质的量之比为1︰1,不能得出正逆反应速率是否相等,A不能说明。根据质量守恒定律可知,质量始终是不变的,B不能说明。因为反应是体积减小的反应,所以在反应过程中气体的物质的量和压强是变化的,直到达到平衡才不再变化,C、E可以说明。选项D中的速率方向是相同的,因此不能说明。选项F属于化学平衡状态的特征,可以说明。
II、(1)1molH2是2g,所以放出的热量是143kJ·g-1×2g=286kJ。
(2)反应热等于断键所吸收的热量和成键所放出的热量的差值,即946kJ+498kJ-2×x=180kJ,解得x=632kJ。


科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| n |
| 3 |
| n |
| 3 |
| V/s | 0 | 50 | 100 |
| c(N2O3)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mo
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) ![]()
2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)

①图像中T2和T1的关系是:T2 T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时,反应后氨的百分含量最大。若容器容积为H,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:
2N2O3![]() 4NO2(g)+O2 △H>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2 △H>0下表为反应在T1温度下的部分实验数据
| Vs | 0 | 500 | 1000 |
| c(N2O3)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 .
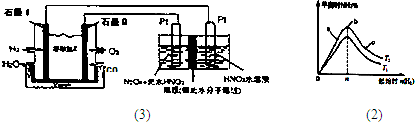
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图所示,其中Y为CO2。

写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O3的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市海安县高二上学期期末考试化学试卷(带解析) 题型:填空题
(14分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
⑴ 在一定体积的密闭容器中,进行化学反应: CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
①该反应正向反应是 反应。(填“放热”或“吸热”)
②能判断该反应达到化学平衡状态的依据是 。
| A.容器压强不变 | B.混合气体中c(CO2)不变 | C.υ正(H2)=υ逆(H2O) | D.c(CO2)=c(CO) |
 CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1 
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com