
重铬酸钾是工业生产和实验室的重要氧化剂。工业上常用铬铁矿(主要成分为FeO·Cr2O3,以及SiO2、Al2O3等杂质)为原料生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下:

图K52
反应器中主要发生的反应为
Ⅰ.FeO·Cr2O3+NaOH+KClO3→Na2CrO4+Fe2O3+H2O+KCl(未配平);
Ⅱ.Na2CO3+SiO2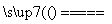 Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
Ⅲ.Al2O3+2NaOH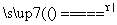 2NaAlO2+H2O。
2NaAlO2+H2O。
在步骤③中将溶液的pH调节到7~8,可以将SiO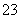 和AlO
和AlO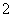 转化为相应的沉淀除去。
转化为相应的沉淀除去。
(1)在反应Ⅰ中氧化剂是________,若有245 g KClO3参加反应,则转移的电子数为______________________。
(2)反应器中生成的Fe2O3又可和Na2CO3反应得到一种摩尔质量为111 g/mol的化合物,该化合物能剧烈水解,在操作②中生成沉淀而除去。写出生成该化合物的化学反应方程式:________________________________。
(3)操作④的目的是将CrO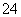 转化为Cr2O
转化为Cr2O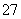 ,其现象为____________________,离子方程式为________________________________________________________________________
,其现象为____________________,离子方程式为________________________________________________________________________
________________________________________________________________________。
(4)请选用合适的方法进一步提纯粗产品重铬酸钾______(填字母)。
A.重结晶 B.萃取分液
C.蒸馏
(5)分析产品中K2Cr2O7的纯度是利用硫酸酸化的K2Cr2O7将KI氧化成I2,然后利用相关物质测出I2的量从而获得K2Cr2O7的量。写出酸化的K2Cr2O7与KI反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(1)KClO3 12×6.02×1023或12NA
(2)Fe2O3+Na2CO3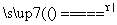 2NaFeO2+CO2↑
2NaFeO2+CO2↑
(3)溶液由黄色变为橙色 2CrO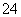 +2H+
+2H+ Cr2O
Cr2O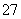 +H2O
+H2O
(4)A
(5)K2Cr2O7+7H2SO4+6KI===Cr2(SO4)3+3I2+7H2O+4K2SO4
[解析] (1)FeO·Cr2O3→Na2CrO4+Fe2O3,Fe的化合价由+2价升高到+3价,铬元素的化合价由+3价升高到+6价,KClO3→KCl氯元素的化合价降低,故KClO3为氧化剂。配平化学反应方程式为6FeO·Cr2O3+24NaOH+7KClO3===12Na2CrO4+3Fe2O3+12H2O+7KCl。245 g KClO3参加反应,转移电子的物质的量为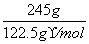 ×6=12 mol。
×6=12 mol。
(2)结合信息可知该化合物含有Na、Fe、O三种元素,结合摩尔质量可知该化合物为NaFeO2。
(3)CrO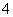 、Cr2O
、Cr2O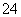 的溶液分别呈黄色、橙色,反应方程式为2CrO
的溶液分别呈黄色、橙色,反应方程式为2CrO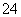 +2H+
+2H+ Cr2O
Cr2O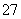 +H2O。
+H2O。
(4)重结晶法是对固体进行提纯的常用方法,萃取分液是利用物质溶解度的差异进行的分离方法,而蒸馏是液体混合物的分离方法。
(5)根据电子守恒和质量守恒可配平化学反应方程式:K2Cr2O7+7H2SO4+6KI===Cr2(SO4)3+3I2+7H2O+4K2SO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH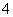 、Mg2+、Al3+、SO
、Mg2+、Al3+、SO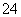 、NO
、NO 、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:
、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:
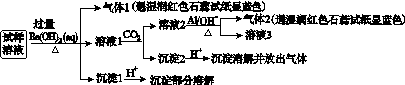
已知:3NO +8Al+5OH-+2H2O
+8Al+5OH-+2H2O 3NH3↑+8AlO
3NH3↑+8AlO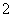
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH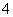 、Mg2+、SO
、Mg2+、SO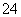 和NO
和NO
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
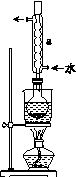
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)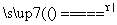 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O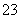 +I2===S4O
+I2===S4O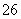 +2I-
+2I-
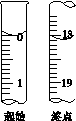
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO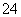 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
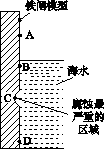
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
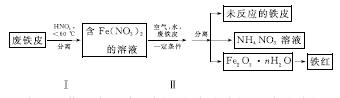
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
(3)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO, t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“乙醇汽油”就是在汽油里加入适量的乙醇混合而成的一种燃料。下列有关叙述不正确的是( )
A.汽车使用乙醇汽油能减少有害气体的排放
B.工业上常用裂化的方法提高汽油的产量和质量
C.乙醇汽油是多种烃的混合物
D.用玉米、高粱发酵可以制得乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
关于右图电化学装置中的电极名称、材料及反应均可能正确的是
A.阴极(Cu片):2Cl--2e-=Cl2↑
B.正极(石墨棒):Fe3++e-=Fe2+
C.阳极(Cu片):4OH--4e-=2H2O+O2↑
D.负极(Fe钉):Fe-3e-=Fe3+
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.Cl2通入NaOH溶液:
Cl2+OH-===Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀盐酸:
CO +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2O===AlO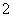 +4NH
+4NH +2H2O
+2H2O
D.Cu溶于稀HNO3:
3Cu+8H++2NO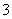 ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com