
【题目】某烃的结构简式为![]() ,它可能具有的性质是
,它可能具有的性质是
A. 它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B. 它既不能使溴水褪色,也不能使酸性高锰酸钾溶液褪色
C. 不易溶于水,也不易溶于有机溶剂
D. 能发生加成反应,一定条件下最多可与四倍物质的量的氢气加成
科目:高中化学 来源: 题型:
【题目】下列物质的分类依据正确的是( )
物质类别 | 分类依据 | |
A | 酸 | 电离时能否产生氢离子 |
B | 碱性氧化物 | 是否属于金属氧化物 |
C | 胶体 | 能否发生丁达尔现象 |
D | 强电解质 | 在水溶液中或熔化状态下能否完全电离 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.σ键一定比π键强度大
B.CO2溶于水和干冰升华都只有分子间作用力改变
C.缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体
D.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5 ℃,易水解。某学习小组在实验室中用下图所示装置制备ClNO。已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3===AgNO3+HNO2。
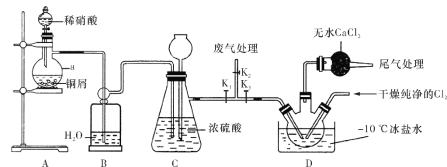
请回答下列问题:
(1)仪器a的名称为________,装置B的作用是________。
(2)装置A中发生反应的化学方程式为________。
(3)装置C中长颈漏斗的作用是________。
(4)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中________时关闭K1、K2。向装置D三颈瓶中通入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO。
(5)装置D中干燥管的作用是________。
(6)ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:________(仅提供的试剂:1 mol·L-1盐酸、1 mol·L-1 HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②要验证ClNO与 H2O 反应后的溶液中存在Cl-和HNO2,合理的操作步骤及正确的顺序是________(填字母代号)。
a.向烧杯中滴加过量KI淀粉溶液,溶液变蓝色
b.取1.0 mL ClNO加入到盛有10.0 mL H2O的烧杯中,充分反应
c.向烧杯中滴加酸性KMnO4溶液,溶液紫红色褪去
d.向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1)①-⑦元素中金属性最强的元素位于周期表中的位置为______________________。
(2)③与⑤形成的化合物溶于水会剧烈反应生成白色沉淀和气体A,请写出该反应的化学方程式 ___________________ ,气体A的实验室制备化学方程式为______________。
(3)④所形成的单质与水反应的方程式 _____________,该反应的类型是_______反应。
(4)②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是__________________(用化学式表示);④所在族的各元素与氢气化合所形成的气态氢化物稳定性由强到弱的顺序是(用化学式表示)__________________。
(5)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。

(1)NO和NO2混合气体与NaOH溶液反应可以合成NaNO2,写出该反应的化学方程式___,生成1mol NaNO2时转移电子______mol
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为______和______,1mol该阴离子中所含的电子总数为______mol
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3![]() K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56 L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56 L。
①该反应中的氧化剂为______还原剂为______(填化学式)
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克______?(写出计算过程,保留一位小数,不考虑固体的体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1。则下列热化学方程式中正确的是
A. ![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l) ΔH=-267 kJ·mol-1
N2(g)+H2O(l) ΔH=-267 kJ·mol-1
B. ![]() N2H4(g)+
N2H4(g)+![]() O2(g) =
O2(g) = ![]() N2(g)+H2O(g) ΔH=+267 kJ·mol-1
N2(g)+H2O(g) ΔH=+267 kJ·mol-1
C. 2N2H4(g)+2O2(g)=2N2(g)+4H2O(g) ΔH=-1068 kJ·mol-1
D. N2(g)+2H2O(l) = N2H4(g)+O2(g) ΔH=+534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | M层上有6个电子 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
用相应的元素符号或化学式回答以下问题
(1)元素X的一种同位素中子数比质子数多1,这种同位素的符号是______。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式______。
(3)元素Z与元素T相比,非金属较强的是______(用元素符号表示)。
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中酸性最强的是______(化学式)
(5)T的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com