
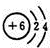 ;B元素的原子最外层电子数与Si相同,二者最外层电子数相同;
;B元素的原子最外层电子数与Si相同,二者最外层电子数相同;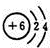 ;二者最外层电子数相同;
;二者最外层电子数相同;
| ||
| ||


科目:高中化学 来源: 题型:
2- 4 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Ba2+、Ag+ |
| B、Ag+、Ba2+、Fe3+ |
| C、Ag+、Ba2+、Mg2+ |
| D、Fe2+、K+、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠是电解质,所以氯化钠固体能导电 |
| B、二氧化碳溶于水得到的溶液能导电,所以二氧化碳是电解质 |
| C、铜能导电,所以铜是电解质 |
| D、碳酸钙难溶于水,但为强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量浓氨水滴入氯化铝溶液:Al3++4NH3?H2O=AlO2-+4NH4++2H2O | ||||
| B、用稀硝酸清洗做过银镜反应的试管:Ag+NO3-+4H+=Ag++NO↑+2H2O | ||||
| C、氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | ||||
D、用二氧化锰与浓盐酸反应制取Cl2:MnO2+4H++2Cl-
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com