
在化学学习、研究中,类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A. CO2和Na2 O2反应生成Na2CO3,推测:SO2和Na2O2反应生成Na2SO3
O2反应生成Na2CO3,推测:SO2和Na2O2反应生成Na2SO3
B.金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭
C. Fe3O4可表示为FeO·Fe2O3,推测:Pb3O4也可表示为PbO·Pb2O3
D. F、C l、 Br,、I的单质熔点依次升高,推测:N、 P、As、 Sb、Bi单质熔点也依次升高
l、 Br,、I的单质熔点依次升高,推测:N、 P、As、 Sb、Bi单质熔点也依次升高
科目:高中化学 来源: 题型:
在容积为1 L的密闭容器中,进行如下反应:A(g)+2B(g)C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
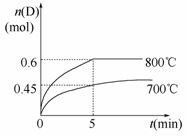
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变
B.混合气体中c(A)不变
C.v正(B)=2v逆(D)
D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”)。
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O。下列说法不正确的是
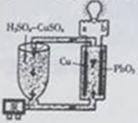
A.a为负极,b为正极 B.该电池工作时PbO2电极附近溶液的pH增大
C.a极的电极反应为Cu-2e-=Cu2+ D.调节电解质溶液的方法是补充CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
己二酸是一种重要的有机二元 酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
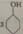 +8HNO3
+8HNO3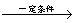 3HOOC(CH2)4COOH+8NO
3HOOC(CH2)4COOH+8NO +7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
+7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
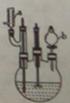
实验步骤:
I.在60mL三颈烧瓶中加入16.0mL50%硝酸(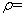 1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
II.首先将瓶内液体加热到50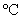 左右,开动搅拌器,滴入环己醇(
左右,开动搅拌器,滴入环己醇(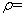 0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90
0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90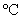 左右水浴加热20分钟,至反应完毕。
左右水浴加热20分钟,至反应完毕。
III.趁热倒出瓶中混合液于烧杯内,烧杯置于冰水浴中,静置冷却,析出产品,过滤,用少量冷水洗涤沉淀,干燥后称重。
IV.将粗产品在水中进行重结晶操作。
请回答下列问题:
(1)仪器a的名称是_________________。仪器b在使用前应_________________。
(2)偏钒酸铵的作用是_______________。
(3)反应完成后,趁热倒出反应液的目的是___ ________________
________________ 。
。
(4)本实验中己二酸的理论产量为______________g。
(5)用纯碱液吸收尾气时发生的相关化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3=2NaNO2+NaNO3+CO2 ②
现用1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况下)CO2 时,吸收液 质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是研究化学的基础。关于下列各装置图的叙述中,正确的是
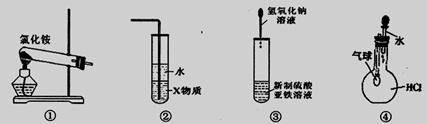
A.装置①常用于实验室制取氨
B.装置②中X若为苯,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④可验证HCl气体在水中的溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 2molO3与3 molO2的质量之比___________,分子数之比__________,同温同压下的密度之比________,含氧原子数之比_______________,体积之比____________________。
(2) O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则相同状况下10LO3与____________L Cl2的消毒能力相当。
(3)气体化合物A分子式可表示为OxFy,己知同温同压下l 0 mL A受热分解生成15 mLO2和10 mL F2,则A的化学式为____________推断的依据为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
 (3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为  (保留两位有效数字)。(
(保留两位有效数字)。(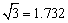 )
)
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图
三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 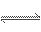 2C (g),若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法正确的是( )
2C (g),若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法正确的是( )
A.用物质A表示的反应速率为0.3 mol/(L·s)
B.用物质B表示的反应速率为0.6 mol/(L·s)
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.7 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com