
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
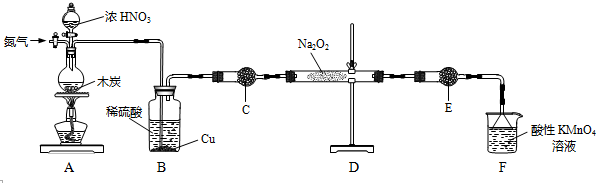
分析 由制备亚硝酸钠的实验装置可知,先通入氮气,将装置中的空气排出,碳与浓硝酸反应生成二氧化氮、二氧化碳,B中可除去二氧化氮,C为球形干燥管,干燥NO气体,D中发生2NO+Na2O2=2NaNO2,E为球形干燥管,防止F中的水蒸气进入D中与过氧化钠反应,F为尾气处理3MnO4-+5NO+4H+=5NO3-+3Mn2++2H2O,实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶、过滤可得CuSO4•5H2O,
(1)装置A中发生反应是浓硝酸和碳加热反应生成二氧化碳、二氧化氮和水;
(2)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;加热装置A前,先通一段时间N2,目的是排出装置中的空气,防止干扰NO和过氧化钠的反应;
(3)充分反应后,检验装置D中产物的方法是利用3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O,反应生成的一氧化氮遇到空气会生成红棕色气体二氧化氮检验;
(4)第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,
A.锥形瓶是否干燥不影响待测液的溶质的物质的量;
B.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,标准液浓度减小;
C.搅拌或转移溶液时有液体溅出,会导致锥形瓶中溶质的损失;
D.锥形瓶用蒸馏水洗净后再用待测液润洗,待测液的物质的量偏大;
(5)第一组数据舍弃,计算出其它3组消耗标准液的平均体积,再结合反应方程式计算出样品中亚硝酸钠的质量及质量分数;
(6)在相同温度下把等浓度的亚硝酸钠和亚硝酸等体积混合,测定溶液PH,若PH大于7说明水解程度大,若pH小于7说明电离程度大.
解答 解:(1)硝酸具有强氧化性,氧化碳为二氧化碳,自身被还原为二氧化氮,反应方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)装置气密性的检查一般常用加热法,依据的原理是:通过加热(用酒精灯或热毛巾或体温)密闭容器,使其中的气体受热膨胀,压强变大,导致放入水中的导管口有气泡冒出(导管应先放入水中),移开热源后,由于装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱,所以组装好仪器,检查装置气密性的操作是关闭活塞,用手捂住烧瓶底部,观察B中长导管液面是否下降,分析装置图可知制备亚硝酸钠需要一氧化氮和过氧化钠反应生成,过氧化钠和二氧化碳、水蒸气发生反应,所以制备的一氧化氮气体必须纯净干燥,装置中无空气存在,加热装置A前,先通一段时间N2,目的是排出装置中的空气,
故答案为:关闭活塞,用手捂住烧瓶底部,观察B中长导管液面是否下降;排除装置内的空气;
(3)3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O,反应生成的一氧化氮遇到空气会生成红棕色气体二氧化氮,充分反应后,检验装置D中产物的方法是:取产物少许置于试管中加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体,证明产物是NaNO2,
故答案为:加入稀硫酸(或稀盐酸),试管内有气泡产生且在试管上方产生红棕色气体;
(4)第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,
A.锥形瓶是否干燥不影响待测液的溶质的物质的量,无需干燥,故A不选;
B.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,滴定过程中消耗的标准液体积会偏大,故B选;
C.振荡时有液体溅出来,溅出的液体中含有待测的亚硝酸钠,消耗的标准液体积会偏小,故C不选;
D.锥形瓶用蒸馏水洗净后再用待测液润洗,导致待测液物质的量偏多,滴定过程中消耗的标准液体积会偏大,故D选;
故答案为:BD;
(5)由于第一组数据偏高,应该舍弃;其它三组消耗标准液平均体积为:$\frac{20.02+20.00+19.98}{3}$mL=20.00mL,
25mL样品消耗高锰酸钾的物质的量为0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为0.002mol×$\frac{250mL}{25mL}$=0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为0.02mol×$\frac{5}{2}$=0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为:$\frac{3.45g}{4.000g}$×100%=86.25%,
故答案为:86.25%;
(6)依据HNO2溶液中存在电离平衡,NO2-存在水解平衡,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小,实验设计为:方法①:配制浓度均为0.1 mol•L-1NaNO2和HNO2的混合液,测溶液的pH,若pH大于7,则NO2-的水解程度大于HNO2的电离程度,若pH<7,则NO2-的水解程度小于HNO2的电离程度.方法②:用pH试纸或pH计分别测定0.1 mol•L-1NaNO2溶液和0.1 mol•L-1HNO2溶液的pH,若HNO2溶液中氢离子浓度大于NaNO2溶液中的氢氧根浓度,则NO2-的水解程度小于HNO2的电离程度,反之,NO2-的水解程度大于HNO2的电离程度,
故答案为:方法①:配制浓度均为0.1 mol•L-1NaNO2和HNO2的混合液,测溶液的pH,若pH大于7,则NO2-的水解程度大于HNO2的电离程度,若pH<7,则NO2-的水解程度小于HNO2的电离程度.方法②:用pH试纸或pH计分别测定0.1 mol•L-1NaNO2溶液和0.1 mol•L-1HNO2溶液的pH,若HNO2溶液中氢离子浓度大于NaNO2溶液中的氢氧根浓度,则NO2-的水解程度小于HNO2的电离程度,反之,NO2-的水解程度大于HNO2的电离程度.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度中等,涉及性质实验方案的设计、中和滴定操作及误差分析、氧化还原反应中电子转移的分析、化学计算等知识,明确实验原理及化学实验基本操作方法为解答关键,试题培养了学生的分析、理解能力及化学实验、化学计算能力.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向煤中加入适量CaO,可大大减少燃烧产物中SO2的量 | |
| B. | 葡萄酒中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
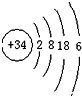 推测硒在元素周期表中第四周期;
推测硒在元素周期表中第四周期;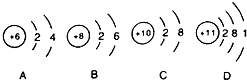
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ①②⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
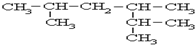
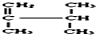 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯;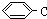 ≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个.
≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个. 表示的分子式C6H14.
表示的分子式C6H14.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业采用火法炼铜:Cu2S+O2=2Cu+SO2 每生成2mol铜,反应共转移4NA个电子 | |
| B. | 7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.1NA | |
| C. | CO2通过Na2O2使其增重bg时,反应中转移的电子数为$\frac{b{N}_{A}}{44}$ | |
| D. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③混合,若溶液pH=7,则体积V(NaOH)>V(CH3COOH) | |
| D. | 将②与④等体积混合,各离子浓度的关系为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| B | 乙酸乙酯(乙酸) | KOH溶液.水 | 分液 |
| C | CO2(CO) | CuO粉末 | 通过灼热的CuO粉末 |
| D | SiO2(Al2O3) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com