

| A、X、Y、Z三种元素中,Y的非金属性最强 |
| B、Y的氢化物的稳定性比Z的氢化物强 |
| C、Z的最高正化合价为+6 |
| D、常压下Z的单质的熔点比Y的低 |


科目:高中化学 来源: 题型:
| A、胶体、溶液、浊液都是分散系 |
| B、粒子的半径:浊液>溶液>胶体 |
| C、可见光通过溶液时,产生丁达尔现象 |
| D、胶体都不透明,且稳定性极强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
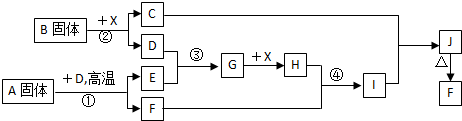
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、250C 时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B、250C 时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C、250C时,Mg(OH)2固体在20ml0.01mol?L-1氨水中的Ksp比在20mL0.01mol?L-1NH4Cl溶液中的Ksp小 |
| D、250C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用醋酸除去暖瓶中的水垢:2H++CaCO3═Ca2++CO2↑+H2O |
| B、利用Na2CO3溶液可除油污:CO32-+2H2O?H2CO3+2OH- |
| C、氢氧燃料电池在酸性介质中的正极反应:O2+4e-+2H2O=4OH- |
| D、汽车用的铅蓄电池充电时阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L酒精含有的分子数约为1NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA |
| C、通常状况下,1NA个CO2分子占有的体积为22.4L |
| D、1NA氧原子的质量(以g为单位)在数值上约等于其相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com