
| A. | 镁片作为负极 | B. | 正极发生氧化反应 | ||
| C. | 电池工作时镁片逐渐被消耗 | D. | 食盐水作为电解质溶液 |
分析 该装置是将化学能转化为电能的装置,Mg易失电子作负极、C作正极,负极反应式为:Mg-2e-+2OH-=Mg(OH)2、正极反应式为:O2+4e-+2H2O=4OH-,食盐水为电解质溶液,据此分析解答.
解答 解:A.根据原电池反应式知,Mg元素化合价由0价变为+2价,所以Mg失电子作负极,故A正确;
B.正极反应式为:O2+4e-+2H2O=4OH-,正极发生的是还原反应,故B错误;
C.Mg作负极,电极反应式为Mg-2e-+2OH-=Mg(OH)2,所以电池工作时镁片逐渐被消耗,故C正确;
D.该原电池中,电解质溶液是食盐水,故D正确;
故选B.
点评 本题考查化学电源新型电池,为高频考点,题目难度不大,明确正负极的判断、原电池原理即可解答,难点是电极反应式的书写,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
 .
. ,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.
,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 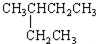 2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. | 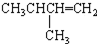 2-甲基丁烯 2-甲基丁烯 | D. | 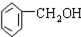 苯甲醇 苯甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
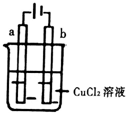
| A. | 电极a表面呈红色 | |
| B. | 电极b作阳极 | |
| C. | 电子由电源的正极沿导线流向电极a | |
| D. | 当电路中通过0.2mol电子时,理论上b电极质量增加6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L HCl溶液中含有0.1NA个HCl分子 | |
| B. | 23gNa在空气中燃烧生成Na2O2时转移电子数目为2NA | |
| C. | 28gCO和N2的混合气体中电子数目为14NA | |
| D. | 11.2LCO2含氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
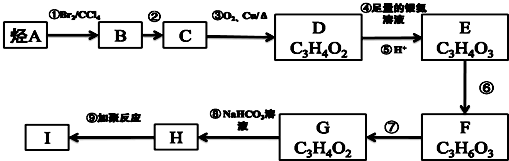
 .
.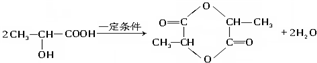 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终可生成0.2 mol NH3 | |
| B. | 增大压强能使反应速率减小 | |
| C. | 降低反应体系的温度能加快反应速率 | |
| D. | 向容器中再加入N2,能加快反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com