
分析 W、X、Y、Z四种短周期元素,W是原子半径最小的元素,则W为H元素;X元素基态原子的2P轨道上只有两个电子,原子核外电子排布式为1s22s22p2,则X为C元素;Y元素的基态原子L层只有2对成对电子,原子核外电子排布式为1s22s22p4,则Y为O元素;Z元素在第三周期元素中电负性最大,则Z为Cl元素.D元素的化合物D3Y4具有磁性,则D为Fe,据此解答.
解答 解:W、X、Y、Z四种短周期元素,W是原子半径最小的元素,则W为H元素;X元素基态原子的2P轨道上只有两个电子,原子核外电子排布式为1s22s22p2,则X为C元素;Y元素的基态原子L层只有2对成对电子,原子核外电子排布式为1s22s22p4,则Y为O元素;Z元素在第三周期元素中电负性最大,则Z为Cl元素.D元素的化合物D3Y4具有磁性,则D为Fe.
(1)CO2的空间构型为直线型,Cl的核外电子排布式为1s22s22p63s23p5,
故答案为:直线型;1s22s22p63s23p5;
(2)某直线型分子由H、C两种元素组成且原子个数比为1:1,该分子为H-C≡C-H,分子中含有 3个σ键,2个π键,碳原子原子的杂化类型为sp,
故答案为:3;2;sp;
(3)向由A、C组成某种化合物的稀溶液中加入少量二氧化锰,有无色气体生成,则该化合物的分子式是H2O2,为展开书页型结构,分子中正负电荷重心不重合,属于极性分子,故答案为:极性;
(4)①Fe的单质与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2 ,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2 ;
②已知Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于分子晶体,故答案为:分子晶体.
点评 本题是对物质结构与性质的考查,涉及核外电子排布规律、杂化理论、化学键、分子结构、晶体类型与性质等,推断元素是解题的关键,难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 自备购物袋,不用塑料方便袋,可以有效控制“白色污染” | |
| B. | 大力发展、推广可利用太阳能.风能的城市照明系统,能够减少温室气体的排放 | |
| C. | 将液电池深埋,可以避免其中的重金属污染 | |
| D. | 建立空调凝结水和屋面雨水收集系统,充分利用水资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示,B离子均在晶胞体内,D的离子分占在晶胞顶点和面心.请回答下列问题.
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示,B离子均在晶胞体内,D的离子分占在晶胞顶点和面心.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲中盛硫酸锌溶液,乙中盛硫酸铜溶液,锌为阴极 | |
| B. | 乙中盛硫酸铜溶液,铜离子在铜电极上被氧化 | |
| C. | 电池工作时,盐桥中的阳离子移向甲,阴离子移向乙,溶液仍保持电中性 | |
| D. | 取出盐桥,电流表指针即回到零点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
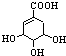 下列关于莽草酸的说法正确的是( )
下列关于莽草酸的说法正确的是( )| A. | 分子式为C7H6O5 | |
| B. | 分子中含有2种官能团 | |
| C. | 可发生加成和取代反应 | |
| D. | 莽草酸遇FeCl3溶液会呈现特征颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | H2O2 | C. | Cl2 | D. | ClO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )| A. | 属于芳香烃 | B. | 只含有两种官能团 | ||
| C. | 不能发生取代反应 | D. | 在一定条件下可以发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com