
| A. | 溶液中存在:[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-] | |
| B. | 若二者等物质的量混合,则溶液中[CO32-]=[HCO3-] | |
| C. | 该溶液中[H+]=Ka2[HCO3-]/[CO32-](Ka2为H2CO3的二级电离常数) | |
| D. | 该溶液加少量水稀释pH不发生明显变化 |
分析 A.溶液中存在电荷守恒,阴阳离子所带电荷总数相同;
B.Na2CO3和NaHCO3等物质的量混合,碳酸根离子水解程度大于碳酸氢根离子;
C.碳酸氢根离子电离平衡存在电离平衡常数;
D.Na2CO3和NaHCO3混合溶液形成的是缓冲溶液.
解答 解:A.Na2CO3和NaHCO3混合溶液中存在电荷守恒:[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-],故A正确;
B.若二者等物质的量混合,碳酸根离子水解程度大于碳酸氢根离子,则溶液中[CO32-]<[HCO3-],故B错误;
C.碳酸氢根离子电离平衡,HCO3-?H++CO32-,平衡常数Ka2=$\frac{[{H}^{+}][C{{O}_{3}}^{2-}]}{[HC{{O}_{3}}^{-}]}$,得到Ka2×[HCO3-]=[CO32-]×[H+],[H+]=Ka2[HCO3-]/[CO32-]=$\frac{K{a}_{2}[HC{{O}_{3}}^{-}]}{[C{{O}_{3}}^{2-}]}$,故C正确;
D.Na2CO3和NaHCO3混合溶液形成的是缓冲溶液,该溶液加少量水稀释pH不发生明显变化,故D正确;
故选B.
点评 本题考查了盐类水解、电解质溶液中电荷守恒、弱电解质电离平衡、缓冲溶液等知识点,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| B | 将铜粉加1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2 溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 稀硝酸和铜反应:Cu+2H+═Cu2++H2↑ | |
| D. | 稀盐酸与碳酸钙反应:2H++CaCO3═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸和氨水反应:H++OH-=H2O | |
| B. | 等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2CIO-+CO2+H2O=CaCO3+2HCIO | |
| D. | 苯酚钠溶液中通入少量二氧化碳:2C6H6O-+CO2+H2O→2C6H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Mg2+、SO42-、NO3- | B. | H+、Mg2+、SO42-、HCO3- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | NH4+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| B. | 使用环形玻璃搅拌棒是为了加大反应速率,减小实验误差 | |
| C. | 用0.5mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 | |
| D. | 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图:用食盐水制食盐晶体 | B. |  如图:分离碘酒中的碘和酒精 | ||
| C. |  如图:稀释浓硫酸 | D. | 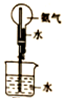 如图:验证氨水的碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com