
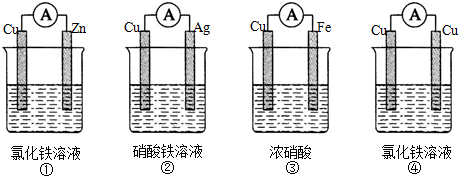
���� ��1����֤Fe3+��Cu2+������ǿ������ԭ����У�ͭ����������������Ľ�����ǽ������������������ҺΪ�����Ե����Σ�
��2���ŵ�ʱǦʧ���Ӷ������������������ת�Ƶ���֮��Ĺ�ϵʽ���㣮
��� �⣺��1����֤Fe3+��Cu2+������ǿ������ԭ����У�ͭ����������������Ľ�����ǽ������������������ҺΪ�����Ե����Σ�
��������������Cu����������ط�ӦʽΪFe+2Fe3+=3Fe2+��������֤Fe3+��Cu2+������ǿ�����ʴ���
����ͭ��������������������ط�ӦʽΪCu+2Fe3+=Cu2++2Fe2+������֤Fe3+��Cu2+������ǿ��������ȷ��
�����������ۻ�����Cu��������������������ط�ӦʽΪ��Cu+2NO3-+4H+=Cu2++2NO2��+2H2O��������֤Fe3+��Cu2+������ǿ�����ʴ���
��������������ͭ����������ط�ӦʽΪ��Fe+Cu2+=Cu+Fe2+��������֤Fe3+��Cu2+������ǿ�����ʴ���
�ʴ�Ϊ���ڣ�
��2�����ݵ�ط�Ӧʽ֪��Ǧʧ���ӻ��ϼ����߶������������������ת�Ƶ���֮��Ĺ�ϵʽ�ã�ת�Ƶ��ӵ����ʵ���=$\frac{��5-x����2}{2}=3$��x=2mol/L��
�ʴ�Ϊ��Ǧ��2��
���� ���⿼����ԭ��غ͵���ԭ���Լ��缫��Ӧʽ����д֪ʶ��ע��ѧ�����Ԫ�ػ��ϼ۱仯ȷ��������ǿ������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�3.36 L�������к��еĵ�����ĿΪ1.5NA | |
| B�� | ���³�ѹ�£�7.0 g��ϩ���ϩ�Ļ�����к��й��õ��ӶԵ���ĿΪ1.5NA | |
| C�� | ��״���£�22.4 L�����к����ۼ���ĿΪ19 NA | |
| D�� | 18 g D2O��18 g H2O�к��е���������Ϊ10NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����NH4Clֻ�ƻ����Ӽ� | |
| B�� | 4.48L�������0.6NA��N-H�� | |
| C�� | PCl3��BCl3����������ԭ�ӵ�����㶼�ﵽ8�����ȶ��ṹ | |
| D�� | ijԪ������������ˮ������⻯��Ļ�ѧʽ�ֱ�ΪH2XO4��H2X |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HF��HCl��HBr��HI�����ȶ������μ��� | |
| B�� | ˮ��ɱ�������ͣ��ܶȱ�С | |
| C�� | NH3��Һ�� | |
| D�� | ����ͬ�����£�H2O�ķе��H2S�ķе�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���й��ۼ��Ļ�����һ���ǹ��ۻ����� | |
| B�� | �ǽ���Ԫ��֮�䲻�����γ����ӻ����� | |
| C�� | ������Ӽ�һ�����ڷ��Ӽ����������������ڲ�һ�������ۼ� | |
| D�� | ���ֲ�ͬ�ķǽ���Ԫ���γɵĻ�����ֻ���ڼ��Թ��ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com