
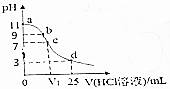
| A. | MOH电离方程式为:MOH═M++OH- | |
| B. | 在b点,离子浓度大小为c(OH-)>c(H+)>c(M+)>c(Cl-) | |
| C. | 在c点,滴加的V(HCl)>12.5mL | |
| D. | 在d点,c(Cl-)=2c(MOH)+2c(M+)=0.1mol•L-1 |
分析 A.MOH是弱碱,则MOH在水溶液中部分电离生成阳离子和氢氧根离子;
B.假设MOH是强碱,b点溶液的pH=9,加入的稀盐酸体积为xmL,则混合溶液中c(OH-)=$\frac{0.1mol/L×0.025L-0.2mol/L×(x×1{0}^{-3})L}{(0.025+x×1{0}^{-3})L}$=10-5 mol/L,x≈12.499,实际上MOH是弱碱,消耗的HCl体积小于12.499mL,则混合溶液中MOH的物质的量很少,溶质主要是MCl,溶液中c(M+)>c(OH-);
C.MOH是弱碱,MCl是强酸弱碱盐,其水溶液呈酸性,要使混合溶液呈中性,则MOH应该稍微过量;
D.d点溶液中溶质为HCl、MCl,且n(HCl)=2n(MOH),根据物料守恒计算.
解答 解:A.MOH是弱碱,则MOH在水溶液中部分电离生成阳离子和氢氧根离子,其电离方程式为MOH?M++OH-,故A错误;
B.假设MOH是强碱,b点溶液的pH=9,加入的稀盐酸体积为xmL,则混合溶液中c(OH-)=$\frac{0.1mol/L×0.025L-0.2mol/L×(x×1{0}^{-3})L}{(0.025+x×1{0}^{-3})L}$=10-5 mol/L,x≈12.499,实际上MOH是弱碱,消耗的HCl体积小于12.499mL,则混合溶液中MOH的物质的量很少,溶质主要是MCl,溶液中c(M+)>c(OH-),溶液呈碱性,则c(OH-)>c(H+),且碱性较弱,溶液中离子浓度大小顺序是c(M+)>c(Cl-)>c(OH-)>c(H+),故B错误;
C.MOH是弱碱,MCl是强酸弱碱盐,其水溶液呈酸性,要使混合溶液呈中性,则MOH应该稍微过量,所以稀盐酸体积应该小于12.5mL,故C错误;
D.d点溶液中溶质为HCl、MCl,且n(HCl)=2n(MOH),溶液体积增大一倍,溶液中离子浓度降为原来的一半,所以d点溶液中c(Cl-)=2c(MOH)+2c(M+)=0.1mol•L-1,故D正确;
故选D.
点评 本题以酸碱混合溶液定性判断为载体考查图象分析及离子浓度大小比较,为高频考点,明确图中各点溶液中溶质成分及其性质是解本题关键,注意B选项采用假设法分析解答,D中溶液体积增大导致离子浓度降低,为易错点.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、OH-、Cl- | B. | H+、AlO2-、Na+、SO42- | ||
| C. | Mg2+、AlO2-、Al3+、NO3- | D. | OH-、AlO2-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | X的最简单气态氢化物的热稳定性比Z的弱 | |
| D. | Z位于元素周期表中第2周期、第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| n(CO2)/mol | 2 | 3 | 4 | 5 |
| n(沉淀)/mol | 2 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40% | B. | 50% | C. | 60% | D. | 83.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X和Y都是性质活泼的元素,在自然界中只能以化合态存在 | |
| B. | X和Y形成的化合物的化学式只能为Y2X2 | |
| C. | X的化合物种类比Y的化合物种类多 | |
| D. | Y能置换酸中氢放出氢气,但不能置换盐中的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com